某同学为了验证海带中含有碘,拟进行以下实验,请回答相关问题。
(1)第1步:灼烧。操作时将足量海带灼烧成灰烬,该过程中将使用到的硅酸盐质实验仪器有 (填代号,限填3项)
A.试管 B.瓷坩埚 C.坩埚钳 D.三脚架
E.泥三角 F.酒精灯 G.烧杯 H.量筒
(2)第2步:I-溶液的获取。操作是 。
(3)第3步:氧化的操作中依次加入合适的试剂。下列氧化剂最好选用 (填代号)
A.浓硫酸 B.新制氯水 C.高锰酸钾溶液 D.双氧水
(4)第4步:碘单质的检验,操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含有碘。
【2015浙江理综化学】(15分)某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一)碘含量的测定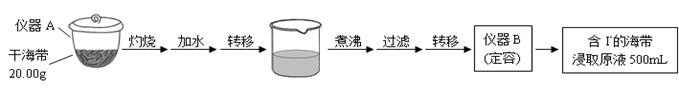
取0.0100 mol·Lˉ1的AgNO3标准溶液装入滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中c(Iˉ)的变化,部分数据如下表:
| V(AgNO3)/mL |
15.00 |
19.00 |
19.80 |
19.98 |
20.00 |
20.02 |
21.00 |
23.00 |
25.00 |
| E/mV |
-225 |
-200 |
-150 |
-100 |
50.0 |
175 |
275 |
300 |
325 |
实验(二)碘的制取
另制海带浸取原液,甲、乙两种实验方案如下: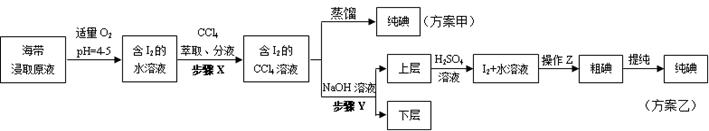
已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
请回答:
(1)实验(一)中的仪器名称:仪器A ,仪器 B 。
(2)①根据表中数据绘制滴定曲线: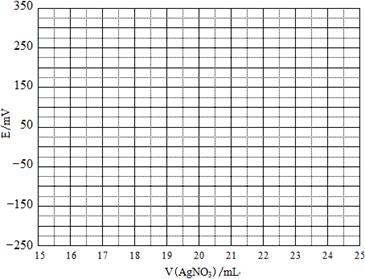
②该次滴定终点时用去AgNO3溶液的体积为 mL,计算得海带中碘的百分含量为 %。
(3)①分液漏斗使用前须检漏,检漏方法为 。
②步骤X中,萃取后分液漏斗内观察到的现象是 。
③下列有关步骤Y的说法,正确的是 。
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以由乙醇代替
④实验(二)中操作Z的名称是 。
(4)方案甲中采用蒸馏不合理,理由是 。
【2015新课标Ⅱ卷理综化学】(15 分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问題:(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为 。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
①电解时发生反应的化学方程式为 。
②溶液X中大量存在的阴离子有__________。
③除去ClO2中的NH3可选用的试剂是 (填标号)。
a.水b.碱石灰c.浓硫酸d.饱和食盐水
(3)用下图装置可以测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入 3 mL稀硫酸:
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液
(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫
代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为 。
②玻璃液封装置的作用是 。
③V中加入的指示剂通常为 ,滴定至终点的现象是 。
④测得混合气中ClO2的质量为 g。
(4)用ClO2处理过的饮用水会含有一定最的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是_______(填标号)。
a.明矾b.碘化钾 c.盐酸 d.硫酸亚铁
【2015新课标Ⅰ卷理综化学】草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是_________,由此可知草酸晶体分解的产物中有_______。装置B的主要作用是________。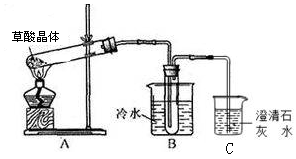
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。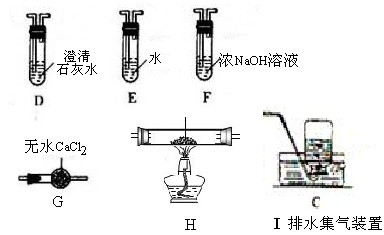
①乙组同学的实验装置中,依次连接的合理顺序为A、B、______。装置H反应管中盛有的物质是_______。
②能证明草酸晶体分解产物中有CO的现象是_______。
(3)设计实验证明:
①草酸的酸性比碳酸的强______。
②草酸为二元酸______。
【2015上海化学】(本题共12分)过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②不断搅拌的同时加入30% H2O2,反应生成CaO2·8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
完成下列填空
(1)第①步反应的化学方程式为 。第②步反应的化学方程式为 。
(2)可循环使用的物质是 。
工业上常采用Ca(OH)2过量而不是H2O2过量的方式来生产,这是因为 。
(3)检验CaO2·8H2O是否洗净的方法是 。
(4)CaO2·8H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是 、 。
(5)已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2含量的装置(夹持装置省略)。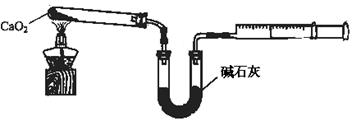
若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为 (用字母表示)。
过氧化钙的含量也可用重量法测定,需要测定的物理量有 。
【2015北京理综化学】研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,写出CO2溶于水产生HCO3-的方程式: 。
(2)在海洋循环中,通过下图所示的途径固碳。
①写出钙化作用的离子方程式: 。
②同位素示踪法证实光合作用释放出的O2只来自于H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整: + ===(CH2O)x+x18O2+xH2O
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2,用N2从酸化后的还说中吹出CO2并用碱液吸收(装置示意图如下),将虚线框中的装置补充完整并标出所用试剂。
②滴定。将吸收液洗后的无机碳转化为NaHCO3,再用xmol/LHCl溶液滴定,消耗ymlHCl溶液,海水中溶解无机碳的浓度= mol/L。
(4)利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。
①结合方程式简述提取CO2的原理: 。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是 。