实验室用 98%、密度为1.84g/cm3的浓硫酸配制0.2mol/L的 H2SO4溶液1000mL.
(1)需要使用的主要仪器有量筒、烧杯、玻璃棒、 、 。
(2)其操作步骤可分解为以下几步:
A.用量筒量取 mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,
并用玻璃棒 搅拌。
搅拌。
B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶 液。
液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①完成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):
( D )→( A )→( C )→( )→( )→( )→( F )。
③将浓硫酸在烧杯中稀释后移入容量瓶时,必须_________________方可移液.
(3)试分析下列操作对所配溶液的浓度有何影响
①量取浓硫酸时眼睛俯视刻度线,会导致所配溶液浓度会 ;(填:偏高、偏低、或无影响,下同)
②定容时,眼睛俯视刻度线,所配溶液浓度会 ;
③定容后,加盖倒转摇匀后,发现溶面低于刻 度线,又滴加蒸馏水至刻度。所配溶液浓度会 .
度线,又滴加蒸馏水至刻度。所配溶液浓度会 .
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是________________________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。加入过量稀盐酸时观察到的现象是______________________________________________________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有__。
(4)下列各项措施中,不能提高测定准确度的是________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,就可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是__________________________________。
某研究性学习小组将一定浓度的Na2CO3溶液滴入MgSO4溶液中得到白色沉淀。甲同学认为两者反应只生成MgCO3一种沉淀;乙同学认为这两者相互促进水解,只生成Mg(OH)2一种沉淀;丙同学认为生成MgCO3和Mg(OH)2两种沉淀。(查阅资料知:MgCO3和Mg(OH)2均不带结晶水)
(1)按照乙同学的理解Na2CO3溶液和MgSO4溶液反应的化学反应方程式为_____________________________;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为①过滤 ②洗涤 ③干燥。
(2)请用下图所示装置,选择合适的实验装置和必要的试剂,证明沉淀物中只有碳酸镁。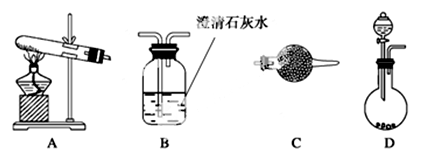
①各装置连接顺序为________________(用装置编号表示);②装置C中装有试剂的名称是______________;
③能证明生成物中只有MgCO3的实验现象是_______。
(3)若Mg(OH)2和MgCO3两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。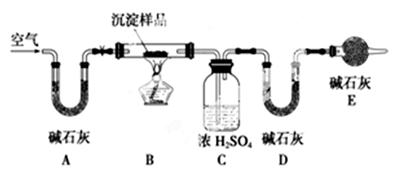
①实验结束时通入过量的空气的作用是________________________。
②A装置和E装置的共同作用是__________________________。
③实验过程中测定的数据有:W1:样品的质量,W2:反应后装置B中残渣的质量,W3:反应生成水的质量,W4:反应生成二氧化碳的质量,为了测定其组成,至少需要其中个数据,请将可能的组合填入下表中(每个空格中填一种组合,至少填5个)。
某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)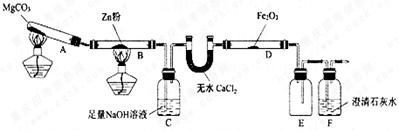
(1)MgCO3的分解产物为。
(2)装置C的作用是,处理尾气的方法为。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 |
操作 |
甲组现象 |
乙组现象 |
| 1 |
取黑色粉末加入稀盐酸 |
溶解,无气泡 |
溶解,有气泡 |
| 2 |
取步骤1中溶液,滴加K3[Fe(CN)6]溶液 |
蓝色沉淀 |
蓝色沉淀 |
| 3 |
取步骤1中溶液,滴加KSCN溶液 |
变红 |
无现象 |
| 4 |
向步骤3溶液中滴加新制氯水 |
红色褪去 |
先变红,后褪色 |
①乙组得到的黑色粉末是。
②甲组步骤1中反应的离子方程式为。
③乙组步骤4中,溶液变红的原因为;溶液褪色可能的原因及其验证方法为。
④从实验安全考虑,题9图装置还可采取的改进措施是_____________________________。
(14分)氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃。在空气中强烈发烟,易与水发生水解反应。人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。在熔融的硫中通入氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。
(1)已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式。
(2)装置a中应放试剂为,其作用为;装置c为何水平放置;
(3)该实验的操作顺序应为(用序号表示)。
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置c
(4)f装置中应放置的试剂为 ,其作用为。
(5)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式。
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在中,再加水稀释,这样操作的目的是。
(2)装置C的作用是。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、、自然干燥,在这一系列操作中没有用到的仪器有(填序号)。
| A.蒸发皿 |
| B.石棉网 |
| C.漏斗 |
| D.烧杯 |
E.玻璃棒
F.坩埚
(4)根据以上现象,该小组同学认为SO2与 FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式;
②请设计实验方案检验有Fe2+生成;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42—。该做法(填“合理”或“不合理”),理由是。
(5)能表明I-的还原性弱于SO2的现象是。