某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)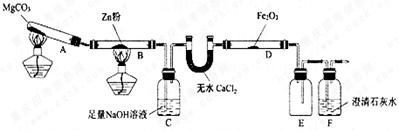
(1)MgCO3的分解产物为 。
(2)装置C的作用是 ,处理尾气的方法为 。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 |
操作 |
甲组现象 |
乙组现象 |
| 1 |
取黑色粉末加入稀盐酸 |
溶解,无气泡 |
溶解,有气泡 |
| 2 |
取步骤1中溶液,滴加K3[Fe(CN)6]溶液 |
蓝色沉淀 |
蓝色沉淀 |
| 3 |
取步骤1中溶液,滴加KSCN溶液 |
变红 |
无现象 |
| 4 |
向步骤3溶液中滴加新制氯水 |
红色褪去 |
先变红,后褪色 |
①乙组得到的黑色粉末是 。
②甲组步骤1中反应的离子方程式为 。
③乙组步骤4中,溶液变红的原因为 ;溶液褪色可能的原因及其验证方法为 。
④从实验安全考虑,题9图装置还可采取的改进措施是_____________________________。
草木灰中含有KCl、K2CO3等钾盐,从草木灰中提取钾盐的实验步骤是:
①称量 ②溶解 ③过滤(④再过滤)⑤滤液蒸发 ⑥冷却结晶
试回答下列问题:
(1)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示(填下列正确选项的字母)
| A.左盘重,样品轻 | B.左盘轻,砝码重 | C.右盘重,砝码轻 | D.右盘轻,样品重 |
(2)在进行第③步操作时,有时可能要重复进行,这是由于
(3)在进行第⑤步操作时,要用玻璃棒不断小心地搅动液体,目的是防止
化学上常用燃烧法确定有机物的组成。如图装置是用燃烧法确定有机物(样品)组成常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品。根据产物的质量确定有机物(样品)的组成。
(1)A装置中锥形瓶内放置MnO2粉末,分液漏斗盛放的物质是________。
(2)C装置(燃烧管)中CuO的作用是___________________________________________。
(3)写出E装置中所盛放物质的名称________,它的作用是________________________。
(4)为了实验数据的准确,需要对装置怎样改进?______________________________。
(5)若准确称取1.20 g样品(只含C、H、O三种元素中的两种或三种)。经充分燃烧后,E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的最简式为________。
(6)要确定该有机物的分子式还要________________。
动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
| 实验步骤 |
实验现象 |
||||
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
|
||||
| ⑤将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失。 |
||||
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉锭。 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究 元素性质递变规律(填“同周期”或“同主族”)。
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。
仪器:① ,② ,③ ,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式)
| 实验内容 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 实验现象(填A~F) |
① ,② ,
(4)实验结论: , 。
(8分,每空2分)工业上制取CuCl2的生产流程如下: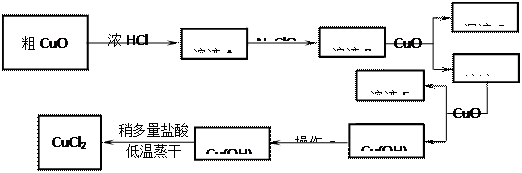
请结合下表数据,回答下列问题:
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| 溶度积/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
| 完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
⑴溶液A中加入NaClO的目的是;
⑵在溶液B中加入CuO的作用是;
⑶操作a的目的是;
⑷在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是。
传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。随着DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)的发明和使用,这一问题有了很大程度的改善。某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判 断滴定终点。实验步骤如下:
断滴定终点。实验步骤如下:
⑴用(填仪器名称)量取10.00mL氨水样品,在(填仪器名称)中用一定量蒸馏水稀释并后转移(含洗涤液)到100mL(填仪器名称)中,用(填仪器名称)加蒸馏水定容、混匀后,将所得溶液装入试剂瓶备用。
⑵量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。 如果锥形瓶中含有少量蒸馏水,是否会影响测量结果(填“是”、“否”、“不能确定”),
如果锥形瓶中含有少量蒸馏水,是否会影响测量结果(填“是”、“否”、“不能确定”),
理由是。
⑶向锥形瓶中滴加0.1000mol/L的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的 曲线图。
曲线图。
①滴定管盛放盐酸前,要先,然后用蒸馏水冲洗2至3次,再用,然后才能盛放盐酸。滴定管中加入盐酸、排净尖嘴部分的气泡后,凹液面的最低点应处于滴定管的。
②氨水与盐酸反应的离子方程式为。
③该氨水样品的物质的量浓度为mol•L-1。
⑷另一学习小组乙认为上述测量结果仍存在一定的误差,因为生成的NH4Cl是强酸弱碱盐,会发生水解而使NH+ 4浓度下降,这样,恰好完全反应时NH+ 4浓度不是最大值,溶液导电性就不会是最大值。
①你认为学习小组乙的结论是否正确?(填“正确” 、“不正确”)
、“不正确”)
②当溶液pH=7时,溶液中各离子浓度大小的关系是。