传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。随着DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)的发明和使用,这一问题有了很大程度的改善。某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判 断滴定终点。实验步骤如下:
断滴定终点。实验步骤如下:
⑴用 (填仪器名称)量取10.00mL氨水样品,在 (填仪器名称)中用一定量蒸馏水稀释并 后转移(含洗涤液)到100mL (填仪器名称)中,用 (填仪器名称)加蒸馏水定容、混匀后,将所得溶液装入试剂瓶备用。
⑵量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。 如果锥形瓶中含有少量蒸馏水,是否会影响测量结果 (填“是”、“否”、“不能确定”),
如果锥形瓶中含有少量蒸馏水,是否会影响测量结果 (填“是”、“否”、“不能确定”),
理由是 。
⑶向锥形瓶中滴加0.1000mol/L的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的 曲线图。
曲线图。
①滴定管盛放盐酸前,要先 ,然后用蒸馏水冲洗2至3次,再用 ,然后才能盛放盐酸。滴定管中加入盐酸、排净尖嘴部分的气泡后,凹液面的最低点应处于滴定管的 。
②氨水与盐酸反应的离子方程式为 。
③该氨水样品的物质的量浓度为 mol•L-1。
⑷另一学习小组乙认为上述测量结果仍存在一定的误差,因为生成的NH4Cl是强酸弱碱盐,会发生水解而使NH+ 4浓度下降,这样,恰好完全反应时NH+ 4浓度不是最大值,溶液导电性就不会是最大值。
①你认为学习小组乙的结论是否正确? (填“正确” 、“不正确”)
、“不正确”)
②当溶液pH=7时,溶液中各离子浓度大小的关系是 。
下图所示装置可用于多种实验。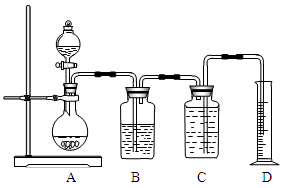
(1)实验室可利用该装置来制取氯气,发生反应的化学方程式为:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
①用双线桥标出上述反应中的电子转移情况。
②B装置的作用是___________________,C装置中盛装的液体最好是。
③若按上述反应制得的氯气体积为4.48 L(标准状况),则实际反应中消耗12 mol/L盐酸的体积大于理论值_______mL。
(2)在实验室要测定部分变质的过氧化钠的纯度,也可用上图装置中的部分仪器。
①上述装置中多余的仪器是_______(填A、B、C、D等序号)。 ②要完成上述实验目的,圆底烧瓶中发生反应的化学方程式为____________________。
②要完成上述实验目的,圆底烧瓶中发生反应的化学方程式为____________________。
③若取用样品的质量为2.5 g,收集到气体的体积为280 mL(标准状况),则样品中Na2O2的纯度为___________。
氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下两种实验方案。
已知:① AlN + NaOH + H2O=NaAlO2 + NH3↑
② NH3极易溶于水,难溶于四氯化碳和苯。
【方案1】用下图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。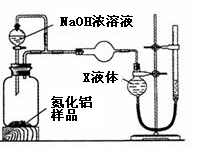
(1)为测定生成气体的体积,量气装置中的X液体可以是_______。
a.CCl4b.H2O
c.NH4Cl溶液d.苯
(2)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AlN的质量分数是___________。(用含m和V的代数式表达)
【方案2】按以下步骤测定样品中A1N的纯度: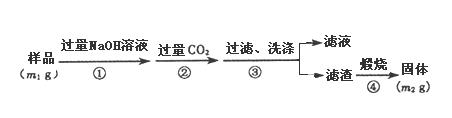
(3)步骤①的化学方程式为AlN + NaOH + H2O=NaAlO2 + NH3↑和___________________。
(4)在步骤③中洗涤沉淀的方法是_____________________________________,若未洗涤,则测定结果将________(填“偏高”、“偏低”或“无影响”)。
(5)样品中AlN的质量分数是___________。(用含m1和m2的代数式表达)
(12分)某同学根据氧化还原反应的知识推测Na2O2与H2能反应。为了验证此推测结果,该同学设计并进行如下实验。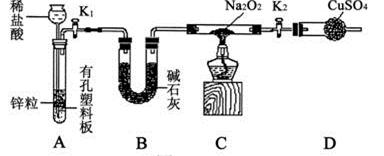
步骤1:按上图组装仪器(图中夹持仪器省略)并检查装置的气密性,然后装入药品;
步骤2:打开K1、K2,产生的氢气在流经装有Na2O2的硬质玻璃管的过程中,没有观察到任何现象;
步骤3:检验完H2的纯度后,点燃酒精灯加热,观察到硬质玻璃管内Na2O2逐渐熔化,淡黄色的粉末慢慢变成了白色固体,干燥管内硫酸铜未变蓝色;
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
(1)实验室利用A装置还可以制备的气体是(写出1种即可)。
(2)盛装CuSO4药品的仪器名称是;B装置的作用是。
(3)必须检验氢气纯度的原因是。
(4)设置装置D的目的是。
(5)由上述实验可推出Na2O2与H2反应的化学方程式为。
阅读下列实验内容,根据题目要求回答问题。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00 mL待测硫酸配制100 mL稀H2SO4溶液;以0.14 mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00 mL,滴定终止时消耗NaOH溶液15.00mL。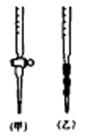
(1)该学生用标准0.14 mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂。 |
| B.用待测定的溶液润洗酸式滴定管。 |
| C.用蒸馏水洗干净滴定管。 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2—3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下。 |
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)。
②该滴定操作中应选用的指示剂是。
③在G操作中如何确定终点?
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“无影响”)。
(3)用标准NaOH溶液滴定时,应将标准NaOH溶液注入滴定管(选填“甲”或“乙”)中。
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定
值(选填“偏大”“偏小”或“无影响”)
(5)计算待测硫酸溶液的物质的量浓度(计算结果精确到小数点后二位)mol·L-1(2分)。
(选考)【化学——选修2:化学与技术】
在富碘卤水中,采用如图所示的工艺流程生产单质碘: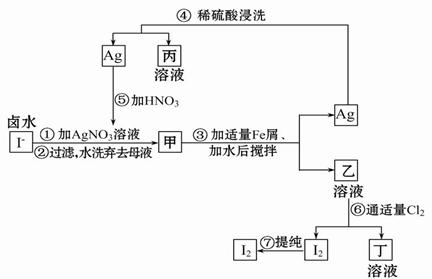
试回答:
(1)乙、丁中溶质的化学式:乙______________;丁____________。
(2)第④步操作中用稀硫酸浸洗的目的是____________(填写字母编号)。
A.除去未反应的AgI
B.除去未反应的I-
C.除去未反应的Fe
(3)第⑦步操作可供提纯I2的两种方法是______和______(不要求写具体步骤)。
(4)实验室检验I2的试剂是_______________。
(5)甲物质见光易变黑,其反应的化学方程_____________________。
(6)反应⑤中所加硝酸应选_________硝酸(填“浓”或“稀”),原因是____________________________。