(14分)氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃。在空气中强烈发烟,易与水发生水解反应。人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。在熔融的硫中通入氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。
(1)已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式 。
(2)装置a中应放试剂为 ,其作用为 ;装置c为何水平放置 ;
(3)该实验的操作顺序应为 (用序号表示)。
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置c
(4)f装置中应放置的试剂为 ,其作用为 。
(5)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式 。
请设计CO2在高温下与木炭反应生成CO的实验。
(1)在下面方框中,A表示有长颈漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置,连接胶管及尾气处理不分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如下: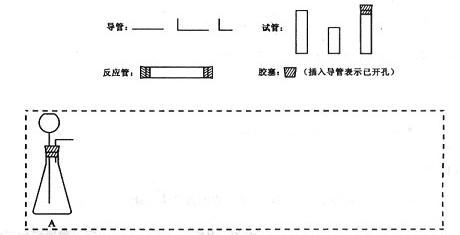
(2)根据方框中的装置图,在答题卡上填写该表
| 仪器符号 |
仪器中所加物质 |
作用 |
| A |
石灰石、稀盐酸 |
石灰石与盐酸生成CO2 |
(3)有人对气体发生器作如下改进:在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中。改进后的优点是 ;
(4)验证CO的方法是 。
有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1)能确定溶液是(写出溶液标号与相应溶质的化学式):
(2)不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
某科研小组用
和浓盐酸制备
时,利用刚吸收过少量
的
溶液对其发扬进行吸收处理。
(1)请完成
与过量
溶液反应的化学方程式:
+2
=。
(2)反应
中的还原剂为。
(3)吸收尾气一段时间后,吸收液(强碱性)肯定存在
和
。请设计实验,探究该吸收液中可能存在的其它离子(不考虑空气的
的影响)
①提出合理假设
假设1:只存在

假设2:既不存在 也不存在
假设3:
②设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3
、1
、0.01
、淀粉-
溶液、紫色石蕊试液.
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3
至溶液呈酸性,然后将所得溶液分置于
试管中 |
 |
| 步骤2: |
|
| 步骤3: |
高纯
是制备高性能磁性材料的主要原料。实验室以
为原料制备少量高纯
的操作步骤如下:
(1)制备
溶液:
在烧瓶中(装置见上图)加入一定量
和水,搅拌,通入
和
混合气体,反应3
。停止通入
,继续反应片刻,过滤(已知
)。
①石灰乳参与反应的化学方程式为。
②反应过程中,为使
尽可能转化完全,在通入
和
比例一定、不改变固液投料的条件下,可采取的合理措施有、。
③若实验中将
换成空气,测得反应液中
、
的浓度随反应时间t变化如下图。导致溶液中
、
浓度变化产生明显差异的原因是。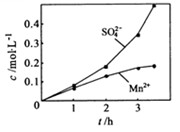
(2)制备高纯
固体:已知
难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;
开始沉淀时
。请补充由(1)制得的
溶液制备高纯
的操作步骤[实验中可选用的试剂:
、
、
、
]。
①;②;③;④;⑤低于100℃干燥。
高纯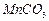 是制备高性能磁性材料的主要原料。实验室以
是制备高性能磁性材料的主要原料。实验室以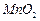 为原料制备少量高纯
为原料制备少量高纯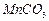 的操作步骤如下:
的操作步骤如下:
(1)制备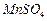 溶液:
溶液: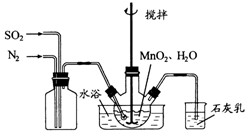
在烧瓶中(装置见上图)加入一定量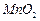 和水,搅拌,通入
和水,搅拌,通入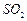 和
和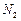 混合气体,反应3h。停止通入
混合气体,反应3h。停止通入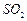 ,继续反应片刻,过滤(已知
,继续反应片刻,过滤(已知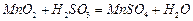 )。
)。
①石灰乳参与反应的化学方程式为。
②反应过程中,为使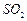 尽可能转化完全,在通入
尽可能转化完全,在通入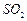 和
和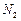 比例一定、不改变固液投料的条件下,可采取的合理措施有、。
比例一定、不改变固液投料的条件下,可采取的合理措施有、。
③若实验中将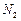 换成空气,测得反应液中
换成空气,测得反应液中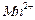 、
、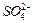 的浓度随反应时间t变化如下图。导致溶液中
的浓度随反应时间t变化如下图。导致溶液中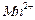 、
、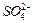 浓度变化产生明显差异的原因是。
浓度变化产生明显差异的原因是。
(2)制备高纯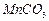 固体:已知
固体:已知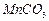 难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;
难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;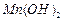 开始沉淀时
开始沉淀时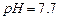 。请补充由(1)制得的
。请补充由(1)制得的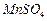 溶液制备高纯
溶液制备高纯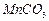 的操作步骤[实验中可选用的试剂:
的操作步骤[实验中可选用的试剂: 、
、 、
、 、
、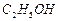 ]。
]。
①;②;③;④;⑤低于100℃干燥。