高纯是制备高性能磁性材料的主要原料。实验室以为原料制备少量高纯的操作步骤如下:
(1)制备溶液:

在烧瓶中(装置见上图)加入一定量和水,搅拌,通入和混合气体,反应3。停止通入,继续反应片刻,过滤(已知)。
①石灰乳参与反应的化学方程式为。
②反应过程中,为使尽可能转化完全,在通入和比例一定、不改变固液投料的条件下,可采取的合理措施有、。
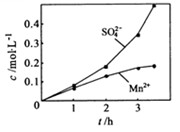
③若实验中将换成空气,测得反应液中、的浓度随反应时间t变化如下图。导致溶液中、浓度变化产生明显差异的原因是 。
(2)制备高纯固体:已知难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;开始沉淀时。请补充由(1)制得的溶液制备高纯的操作步骤[实验中可选用的试剂:、、、]。
①;②;③;④;⑤低于100℃干燥。
探究SO2的性质。甲组同学将SO2分别通入下列3种溶液中。
(1)试管a中观察到的现象是_____________。
(2)试管b中观察到紫色褪去,说明SO2具有的性质是_____________。
(3)试管c中产生了能溶于稀盐酸的白色沉淀,该白色沉淀是_____________。
(4)乙组同学多做了一组实验,他们将SO2通入盛有1.0 mol/L Fe(NO3)3和BaCl2的混合溶液(已 知1.0 mol/L Fe(NO3)3溶液中c(H+)=0.1 mol/L)的试管d中,得到了不溶于稀盐酸的白色沉淀。分析产生该白色沉淀的原因:
观点1:SO2与Fe3+反应
观点2:在酸性条件下SO2与NO3-反应
观点3:__________。
欲证明观点2,只需将试管d中Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是__________(填字母)。
a. 0.1 mol/L稀硝酸
b. 1.5 mol/L Ba(NO3)2和0.1 mol/L HNO3的混合溶液
c. 6.0 mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液
已知乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
| 溶解性 |
沸点(℃) |
密度(g/mL) |
|
| 乙醇 |
与水互溶 |
78.5 |
0.8 |
| 溴乙烷 |
难溶于水 |
38.4 |
1.4 |
某研究性学习小组的同学将乙醇、80%的硫酸、NaBr固体按一定比例混合后(总体积约140 mL)置于图1的反应容器B中后进行加热(两个装置中的加热、固定装置及沸石均省略)。
(1)①仪器A的名称是: ;
②容器B的容积是: ;
a.150 mL b.200 mL c.250 mL
(2)两个水槽中的液体均是冰水,使用冰水的目的是 。
(3) HBr与乙醇反应生成目标产物的化学方程式 。
(4)图1中收集到的产品中含有一定量的杂质Br2.为除去该杂质,可先向混合液中加入适量的(从下面所给试剂中选取) ,然后再进行 操作即可。
a.四氯化碳 b.碳酸钠稀溶液 c.无水CaCl2 d.无水MgSO4
(5)经过(4)处理后的目标产物中还含有少量的水等杂质,可通过向产品中加入一定量的 (从上面的a~d中选取),充分作用后,过滤,将滤液使用图2中的装置进行提纯,冷却水应从 口(填a或b)进入。
(6)若实验中使用的无水乙醇的体积是46 mL,蒸馏后得到的纯溴乙烷的体积是50 rnL,则溴乙烷的产率为 %。
某化学小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:
(1)他们制备Cl2依据的原理是: ,应选用上图A~E装置中的 (填序号)制Cl2。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是 。
(3)装置C的作用是 。
(4)若装置B、D中的品红溶液均换成紫色石蕊溶液,则B试管中的现象是 。
(5)SO2与Cl2以体积比1︰1混合后通入水中,是否还有漂白性 (填“是”或“否”),原因是(用化学方程式表示): 。
为了将混有Na2SO4、NaHCO3的NaCl提纯,并制得纯净的溶液,某学生设计了如图所示的实验方案:
(1)操作①盛放药品可选用 (填仪器名称)。操作①中发生反应的化学方程式是: 。
(2)操作②为什么不用Ba(NO3)2溶液,其理由是 。
(3)进行操作②后,如何判断杂质已除尽?方法是 。
(4)操作③的目的是 ;为何不先过滤后加Na2CO3溶液,其理由是 。
(5)此设计方案是否严密?请说明理由 。
三氯化铬是合成其它铬盐的重要原料,在无机合成和有机合成中有重要的作用,是合成饲料添加剂的主要成份,工业上主要用作媒染剂及催化剂。易溶于水,溶于乙醇,几乎不溶于乙醚,易潮解,易升华。在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)且2 CrO42- + 2 H+⇌Cr2O72- + H2O。制三氯化铬的流程如下:

(1)三氯化铬碱性条件下被H2O2氧化为Cr(Ⅵ)的离子反应方程式为__ 。
(2)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,适宜的加热方式是_________________。
(3)用如图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通入氮气,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度控制在50~60℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通入氮气;⑥检查装置气密性。正确的操作顺序为:⑥→③→__________,步骤②中通如氮气的作用_______________。
(4)已知反应管中发生的主要反应有:Cr2O3+3CCl4→2CrCl3+3COCl2,因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式_____ 。
(5)样品中三氯化铬质量分数的测定称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O72-存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2=Na2S4O6+2NaI。
①指示剂为___________,滴定终点的现象为________________________________。
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是 。
③样品中无水三氯化铬的质量分数为 。(计算结果精确到0.1%)