某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在 中,再加水稀释,这样操作的目的是 。
(2)装置C的作用是 。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、 、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)。
| A.蒸发皿 |
| B.石棉网 |
| C.漏斗 |
| D.烧杯 |
E.玻璃棒
F.坩埚
(4)根据以上现象,该小组同学认为SO2与 FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式 ;
②请设计实验方案检验有Fe2+生成 ;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42—。该做法 (填“合理”或“不合理”),理由是 。
(5)能表明I-的还原性弱于SO2的现象是 。
.某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,检验反应的部分副产物,并探究溴乙烷的性质。
(一)溴乙烷的制备及产物的检验:设计了如上图装置,其中夹持仪器、加热仪器及冷却水管没有画出。请根据实验步骤,回答下列问题:
(1)仪器A的名称是
(2)制备操作中,加入的少量的水,其目的是。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发d.水是反应的催化剂
(3)加热片刻后,A中的混合物出现橙红色,该橙红色物质可能是____________
(4)理论上,上述反应的副产物还可能有:乙醚(CH3CH2-O-CH2CH3)、乙烯、溴化氢等
① 检验副产物中是否含有溴化氢:熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验。B、C中应盛放的试剂分别是、
② 检验副产物中是否含有乙醚:通过红外光谱仪鉴定所得产物中含有“-CH2CH3”基团,来确定副产物中存在乙醚。请你对该同学的观点进行评价:
(5)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(二)溴乙烷性质的探究:
用右图实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
Ⅰ:在试管中加入10 mL6mol/L NaOH溶液和2 mL 溴乙烷,振荡。
II:将试管如图固定后,水浴加热。
(1)观察到___________现象时,表明溴乙烷与NaOH溶液已完全反应。
(2)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图装置。A试管中的水的作用是,若无A试管,B试管中的试剂应为。
.可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空:
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2mL,正确加入顺序操作是_____________________________________________。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是 ____________
(3)实验中加热试管的目的是:① ________________________________
②__________________________________________________________________
(4)试管b中加有饱和Na2CO3溶液 ,其作用是_____________________________
(5)反应结束后,振荡试管b静置,观察到的现象是___________________________
(6)制取乙酸乙酯的化学方程式___________________________
(10分)利用天然气合成氨的工艺流程示意如下:
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是
(2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2mol(用含n的代数式表示)
(3)K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是(多选扣分)
(a)相似相溶原理(b)勒沙特列原理(c)酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于(写出CO2的一种重要用途)。
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子),制备BaCl2.2H2O,工艺流程如下:
已知:
①常温下Fe3+、Mg2+完全沉淀的PH分别是3.4、12.4
②BaCO3的相对分子质量是197;BaCl2.2H2O的相对分子质量是244
回答下列问题:
⑴SiCl4发生水解反应的化学方程式_______________________________________
⑵SiCl4用H2还原可制取纯度很高的硅,当反应中有1mol电子转移时吸收59KJ热量,则该反应的热化学方程式为_____________________________________________
⑶加钡矿粉调节PH=7的作用是①使BaCO3转化为BaCl2 ②_______________________
⑷生成滤渣A的离子方程式__________________________________________
⑸BaCl2滤液经______、________、过滤、_________,再经真空干燥后得到BaCl2.2H2O
⑹10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2.2H2O___________吨。
(14分)长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定亚硫酸钠试剂被氧化的程度,设计了下图实验,请回答下面的问题: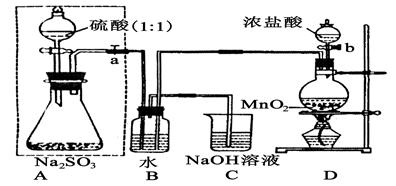
(1)D装置中反应的化学方程式为。
B装置中反应的离子方程为。
(2)称量ag Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应、过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分为数为:。
(3)为保证实验测定的准确性,A中的硫酸什么时候滴加
C装置中的作用是 _________________。
(4)现有以下试剂:①蒸馏水、②稀盐酸、③稀硝酸、④BaCl2溶液、⑤Ba(NO3)2溶液,请从中选择合适试剂,设计一种不同的实验方法,测定试样中无水亚硫酸钠被氧化的程度,你使用试剂的顺序为:。(填试剂编号)