多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子),制备BaCl2.2H2O,工艺流程如下:
已知:
①常温下Fe3+、Mg2+完全沉淀的PH分别是3.4、12.4
②BaCO3的相对分子质量是197;BaCl2.2H2O的相对分子质量是244
回答下列问题:
⑴SiCl4发生水解反应的化学方程式_______________________________________
⑵SiCl4用H2还原可制取纯度很高的硅,当反应中有1mol电子转移时吸收59KJ热量,则该反应的热化学方程式为_____________________________________________
⑶加钡矿粉调节PH=7的作用是①使BaCO3转化为BaCl2 ②_______________________
⑷生成滤渣A的离子方程式__________________________________________
⑸BaCl2滤液经______、________、过滤、_________,再经真空干燥后得到BaCl2.2H2O
⑹10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2.2H2O___________吨。
铁在冷的浓硫酸中能发生钝化现象。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。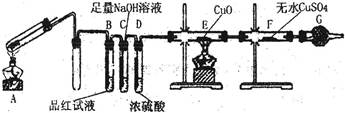
(1)证明反应所产生的气体中有SO2生成的现象是。
(2)证明气体中含有氢气的实验现象是。
(3)为了进一步探究反应后A溶液中铁元素的价态,他们进行了如下的假设:
假设1:溶液中铁元素既有Fe3+也有Fe2+
假设2:溶液中铁元素只有Fe3+
假设3:溶液中铁元素只有________________
基于假设1,现有试剂:0.01 mol/L酸性KMnO4溶液、稀溴水溶液、0.1 mal/L KI溶液、
淀粉溶液、KSCN溶液,蒸馏水。请探究其所得溶液。请完成表中内容。
【实验探究】
| 实验操作 |
预期现象 |
结论 |
| 取反应后的A溶液分装在a、b两试管,步骤①:往a试管中滴入 。 |
||
| 步骤②:往b试管中滴入 。 |
溶液含有Fe3+ |
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等元素的化合物杂质)为原料获得。有关工艺流程如下:
(1)往废渣中加H2SO4酸漫,要充分搅拌,其目的是。
(2)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式。
(3)加6%的H2O2时,温度不能过高,其目的是。
(4)除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀。在上述方法中,氧化剂可用NaClO3代替,用NaClO3氧化Fe2+的离子方程式为。
(5)上述流程中滤液III的溶质的主要成分是:。
(6)操作I包括以下过程:过滤,用H2SO4溶解,、、过滤、洗涤获得产品。
某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4。溶液中得到蓝色沉淀。关于沉淀的成分,有以下几种假设:
假设1:沉淀是CuCO3;
假设2:沉淀是Cu(OH)2;
假设3:沉淀是_____________________________________。
(1)若假设1成立,则发生反应的离子方程式为_______________________________。
(2)若假设2成立,原因是__________________________________________________。
(3)该研究性学习小组拟用以下装置测定沉淀成分,请完成下表。已知:①CuCO3和Cu(OH)2均不带结晶水;②装置气密性良好;③原装置中的空气对实验结果的影响可忽略。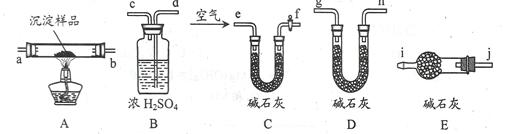
| 实验步骤 |
预期现象 |
结论 |
| ①称量B、D的质量分别为ml、m2,将装置按 f→a→b→___→___→___→___→j→i顺序连接。 |
||
| ②称取一定质量的沉淀______________________,然后___________________,冷却后再称量B、D的质量分别为m3、 m4 |
(1)若m1 = m3,m2 < m4 (2)若m1___m3,m2___m4 (3)若ml___m3,m2___m4 |
(1)假设1成立 (2)假设2成立 (3)假设3成立 |
(4)若沉淀样品的质量为w克,装置B质量增加了x克,则沉淀中Cu(OH)2的质量分数为__________________________。[已知Cu(OH)2的式量为98]
根据镁与二氧化碳的反应推测,钠也能在二氧化碳中燃烧,且固体产物可能为碳酸钠、氧化钠、碳中的两种或三种。某兴趣小组对钠在二氧化碳中燃烧后的产物进行定性和定量探究。
(1)假设产物为Na2CO3、Na2O和C的混合物,设计实验方案,验证其中的Na2CO3和Na2O。在答题卡上写出实验步骤、预期现象和结论。(已知室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、BaCl2溶液、Ba(OH)2溶液、精密pH试纸(精确至0.1)、烧杯、试管、滴管、玻璃棒、表面皿、比色卡
| 实验操作 |
预期现象和结论 |
| 步骤1:取适量产物样品于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,取上层清液备用。 |
有不溶的黑色固体。 |
| 步骤2:取适量步骤1清液于试管中, |
|
| 步骤3: |
(2)假设产物为Na2CO3、Na2O和C的混合物,为进一步测定产物中Na2CO3的含量,进行了以下实验:
步骤1:准确称取w克试样,溶解、过滤后准确配制成250mL溶液。
步骤2:准确量取25.00mL所配溶液于锥形瓶中,滴加几滴指示剂A,滴加c mol/L的标准盐酸至溶液的pH约为8.2(碳的主要存在形式为HCO3―),消耗盐酸的体积为V1mL;再滴加几滴甲基橙,继续用上述盐酸滴至溶液由黄色变橙色,消耗盐酸的体积为V2mL。
步骤3:重复实验3次。滴定结果如下
| 滴定 次数 |
待测溶液 的体积/mL |
消耗标准盐酸的体积 |
|
| V1/mL |
V2/mL |
||
| 1 |
25.00 |
15.02 |
4.97 |
| 2 |
25.00 |
14.98 |
5.03 |
| 3 |
25.00 |
13.21 |
6.75 |
①步骤2中,第一步滴定所使用的A指示剂为,滴定终点的现象为。
②计算Na2CO3的质量分数=(用含w、c的代数式表示)
工业上用异丙苯氧化法合成苯酚,其生产流程如下图: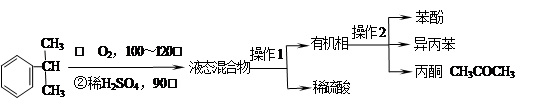
有关物质的性质如下表:
| 物质 |
沸点 |
溶解性 |
主要化学性质 |
| 异丙苯 |
152.4℃ |
不溶于水,易溶于酒精。 |
可被强氧化剂氧化 |
| 苯酚 |
181.8℃ |
微溶于冷水,易溶于热水和酒精等有机溶剂。 |
易被氧化 |
| 丙酮 |
56.2℃ |
易溶于水和有机溶剂 |
不易被氧化 |
(1)检验有机相中是否含有水的方法是;
(2)“操作2”的名称是;
(3)丙酮中常含有苯酚和异丙苯中的一种或者两种有机物杂质,某同学做了如下检验。
| 检验项目 |
实验方案 |
| 检验丙酮中一定存在有机杂质的方法是 |
A.酸性KMnO4溶液,加热 B.乙醇,溶解 C.NaOH溶液(酚酞),加热 |
| 检验丙酮中一定含有苯酚的方案是: |
取少许待测液置于试管中,滴加1~2滴FeCl3溶液。预期的实验现象和结论是。 |
(4)某同学对该厂废水进行定量分析。取20.00mL废水于锥形瓶中,水浴加热,用0.1000mol·L-1酸性KMnO4溶液滴定(假定只有苯酚与KMnO4反应)。达到滴定终点时,消耗KMnO4溶液的体积为10.00mL。有关反应方程式为:
5 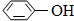 + 28KMnO4 + 42H2SO4
+ 28KMnO4 + 42H2SO4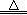 28MnSO4 + 14K2SO4 + 30CO2↑+ 57H2O
28MnSO4 + 14K2SO4 + 30CO2↑+ 57H2O
①滴定终点的现象为。
②该废水中苯酚的含量为mg·mL-1。(保留二位有效数字)。