.某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,检验反应的部分副产物,并探究溴乙烷的性质。
(一)溴乙烷的制备及产物的检验:设计了如上图装置,其中夹持仪器、加热仪器及冷却水管没有画出。请根据实验步骤,回答下列问题:
(1)仪器A的名称是
(2)制备操作中,加入的少量的水,其目的是 。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(3)加热片刻后,A中的混合物出现橙红色,该橙红色物质可能是____________
(4)理论上,上述反应的副产物还可能有:乙醚(CH3CH2-O-CH2CH3)、乙烯、溴化氢等
① 检验副产物中是否含有溴化氢:熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验。B、C中应盛放的试剂分别是 、
② 检验副产物中是否含有乙醚:通过红外光谱仪鉴定所得产物中含有“-CH2CH3”基团,来确定副产物中存在乙醚。请你对该同学的观点进行评价:
(5)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是 。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(二)溴乙烷性质的探究:
用右图实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
Ⅰ:在试管中加入10 mL6mol/L NaOH溶液和2 mL 溴乙烷,振荡。
II:将试管如图固定后,水浴加热。
(1)观察到___________现象时,表明溴乙烷与NaOH溶液已完全反应。
(2)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图装置。A试管中的水的作用是 ,若无A试管,B试管中的试剂应为 。
工业上用重铬酸钠(
)结晶后的母液(含少量杂质
)生产重铬酸钾(
),工艺流程及相关物质溶解度曲线如图: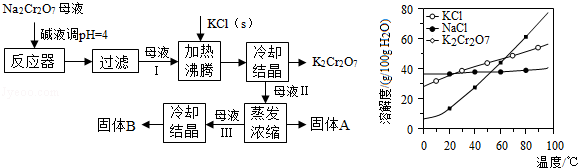
(1)由
生产
的化学方程式为,通过冷却结晶析出大量
的原因是.
(2)向
母液中加碱液调
的目的是 .
(3)固体
主要为(填化学式),固体
主要为(填化学式).
(4)用热水洗涤固体
,回收的洗涤液转移到母液(填"Ⅰ""Ⅱ"或"Ⅲ")中,既能提高产率又可使能耗最低.
工业上常利用含硫废水生产
,实验室可用如下装置(略去部分加持仪器)模拟生成过程。

烧瓶
中发生反应如下:
(I)
(II)
(III)
(1)仪器组装完成后,关闭两端活塞,向装置
中的长颈漏斗内注入液体至形成一段液注,若,则整个装置气密性良好。装置
的作用是。装置
中为溶液。
(2)为提高产品纯度,应使烧瓶
中
和
恰好完全反应,则烧瓶
中
和
物质的量之比为。
(3)装置B的作用之一是观察
的生成速率,其中的液体最好选择。
a.蒸馏水 b.饱和
溶液
c.饱和
溶液 d.饱和
溶液
实验中,为使
缓慢进入烧瓶
,采用的操作是。已知反应(III)相对较慢,则烧瓶
中反应达到终点的现象是。反应后期可用酒精灯适当加热烧瓶
,实验室用酒精灯加热时必须使用石棉网的仪器含有。
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(4)反应终止后,烧瓶
中的溶液经蒸发浓缩即可析出
,其中可能含有
、
等杂质。利用所给试剂设计实验,检测产品中是否存在
,简要说明实验操作,现象和结论:。
已知
遇酸易分解:
↓
↑
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、
溶液、
溶液
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线: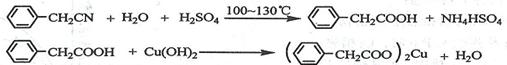
制备苯乙酸的装置示意图如下(加热和夹持装置等略):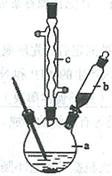
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是;仪器c的名称是,其作用是。反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是。下列仪器中可用于分离苯乙酸粗品的是(填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是,最终得到44 g纯品,则苯乙酸的产率是。
(4)用
和
溶液制备适量
沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入
搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是。
磷酸铁(
,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是。
(2)向滤液中加入一定量
氧化
。为确定加入
的量,需先用
标准溶液滴定滤液中的
,离子方程式如下:
①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、和。
②若滴定x
滤液中的
,消耗a
标准溶液b
,则滤液中
=
③为使滤液中的
完全被
氧化,下列实验条件控制正确的是(填序号)。
| A. | 加入适当过量的 溶液 | B. | 缓慢滴加 溶液并搅拌 |
| C. | 加热,使反应在较高温度下进行 | D. | 用氨水调节 =7 |
(3)将一定量的 溶液(溶液显碱性)加入到含有 的溶液中,搅拌、过滤、洗涤、干燥得到 。若反应得到的 固体呈棕黄色,则磷酸铁中混有的杂质可能为。
实验室从含碘废液(除
外,含有
、
、
等)中回收碘,其实验过程如下:
(1)向含碘废液中加入稍过量的
溶液,将废液中的
还原为
,其离子方程式为;该操作将
还原为
的目的是。
(2)操作X的名称为。
(3)氧化时,在三颈烧瓶中将含
的水溶液用盐酸调至pH约为2,缓慢通入
,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是;锥形瓶里盛放的溶液为。
(4)已知: 某含碘废水(pH约为8)中一定存在 ,可能存在 、 中的一种或两种。请补充完整检验含碘废水中是否含有 、 的实验方案:取适量含碘废水用 多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在;
。
实验中可供选择的试剂:稀盐酸、淀粉溶液、
溶液、
溶液