黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料。某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
II.反应结束后,将乙瓶中的溶液进行如图2处理。
[实验二]测定铁元素的含量。III。测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2+)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是 。
(2)I中,甲瓶内所盛试剂是 溶液;乙瓶内发生反应的离子方程式有 ;I中玻璃纤维的作用是 。
(3)II中,所加H2O2溶液需足量的理由是 。
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有 ;
(5)该黄铁矿中硫元素的质量分数 (用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数 (用I、II中有关实验数据表达)
碳元素是构成有机物的基础元素。
(1)写出碳元素核外电子排布式。
(2)甲烷与水分子相对分子质量差距不大但溶沸点却有很大差距,原因是。
(3)分析甲烷、乙烯、乙炔中碳原子杂化方式。
(4)已知CO2晶胞结构如下,已知其晶胞边长为a cm,NA表示阿伏加德罗常数,其密度为g/cm3。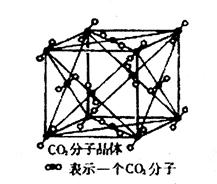
海水的综合利用,对于人类的生产生活有重要的意义。
(1)海水淡化沿海缺水地区获取淡水的方法之一,列举出海水淡化的两种方法、。
(2)氯碱工业离子交换膜法生产中,透过离子交换膜的离子为,氢氧化钠产生于(填‘“阳极”或“阴极”)。
(3)氯化钠为工业制纯碱的主要原料,制碱反应过程中法中析出NaHCO3的原因是;侯氏制碱法与索尔维制碱法相比除提高食盐利用率、无氯化钙生成的优势外还有、从而综合利用原料、降低成本、减少环境污染。
合成气是以H2、CO等为主要组成的供化学合成的原料气,回答有关问题:
(1)甲烷在一定条件下与水反应可得合成气,该反应中每转移1.2mol电子,所得合成气在表况下的体积为L。
(2)合成气在合成氨气时需除去CO,可利用以下反应: CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g) H=-41.16kJ/mol,对于该反应有关表述正确的是。
H=-41.16kJ/mol,对于该反应有关表述正确的是。
a.其他条件不变,缩小体系体积增大压强时反应速率不变,所以平衡不移动
b.绝热条件下,若测得该体系温度不再改变,则反应处于平衡状态
c.温度升高,该反应平衡常数增大
d.为提高CO转化率,可适当增加水蒸气用量
某温度下,H2O和CO按体积比5:l充入某恒容反应器,平衡时测得CO与CO2体积比l:9,则该条件下的平衡常数为(保留两位有效数字)
(3)为除去(2)中生成的CO2,可用碳酸钾溶液吸收,常温下pH=10的碳酸钾溶液中水电离的OH- 的物质的量浓度为,碳酸氢钾溶液中离子浓度大小顺序为
(4)CO2和NH3在一定条件下反应生成尿素[CO(NH2)2]:CO2(g)+2NH3(1)=H2O(1)+CO(NH2)2(1),CO2的转化率随温度变化曲线如下,则该反应 H 0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理。
H 0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理。
( 12分)钛(Ti)被称为继铁、铝之后的第三金属,钝钛和以钛为主的合金是新型的结构材料,主要用于航天工业和航海工业,下列是有关钛的冶炼及应用的问题。
(1)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2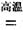 TiCl4+2CO
TiCl4+2CO
已知:C(S)+O2(g)=CO2(g) H=-393.5 kJ·mol-1
H=-393.5 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) H=-566 kJ·mol-1
H=-566 kJ·mol-1
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) H=+141 kJ·mol-1
H=+141 kJ·mol-1
则TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的 H=,
H=,
(2)钠热还原法是冶炼金属钛的方法之一,主要反应原理为:4Na+TiCl4 4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因(用适当化学方程式辅以必要的文字说明)。
4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因(用适当化学方程式辅以必要的文字说明)。
(3)镁还原法也是冶炼金属钛的常用方法,其主要反应原理如下:
MgCl2 Mg+Cl2 TiCl4+2Mg
Mg+Cl2 TiCl4+2Mg  2MgCl2+Ti
2MgCl2+Ti
从海水中提取MgCl2时,先在海水中加入熟石灰,沉淀出Mg(OH)2,写出Mg(OH)2溶度积表达式:
可加入适当过量的熟石灰,从Mg(OH)2溶解平衡角度解释其原因
(4)TiCl4与LiOH在水溶液中一定条件下可反应生成Li4Ti5O12(钛酸锂),Li4Ti5O12可与LiMn2O4(锰酸锂)等正极材料组成理离子二次电池,工作时Li+ 在电池内定向移动,其电池反应为: ,使用时先充电,写出其充电式的阳极反应,放电时Li+的移动方向。
,使用时先充电,写出其充电式的阳极反应,放电时Li+的移动方向。
高分子材料M在光聚合物和金属涂料方面有重要用途,M的结构简式为:
已知:A完全燃烧只生成CO2和H2O,其蒸气密度是相同状况下氢气密度的43倍,分子中H、0原子个数比为3:1。它与Na或N a2CO3都能反应产生无色气体。
a2CO3都能反应产生无色气体。
(1)A中含有的官能团的名称是。
(2)下列说法正确的是(填序号字母)。
a.工业上,B主要通过石油分馏获得
b.C的同分异构体有2种(不包括C)
c.D在水中的溶解性很大,遇新制Cu(OH)2悬浊液,溶液呈绛蓝色
d.E—M的反应是缩聚反应
(3)写出A+D+H3PO4--E反应的化学方程式:,该反应类型是。
(4)F是A的一种同分异构体,F的核磁共振氢谱显示分子中有两种不同的氢原子。存在下列转化关系:
写出F、N的结构简式为:F:N:
写出反应①的化学方程式____