(1)重铬酸钾(K2Cr2O7)是一种应用广泛的强氧化剂,它常用铬铁矿(主要是FeO、Cr2O3)在氯酸钾的氧化下制备出K2CrO4 ,将K2CrO4溶于稀硫酸酸化得到重铬酸钾溶液,请写出酸化K2CrO4制备K2 Cr2 O7溶液的平衡离子方程式: , 这一过程溶液的颜色从 到 。
(2)酒驾检测时,酸性的K2Cr2O7将乙醇氧化成乙酸,同时自身还原成绿色的离子,涉及的离子方程式 为: 。
(3)TiCl4遇到高温水蒸气就会水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到胶体TiO2,为什么水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因: 检验TiO2·x H2O中Cl-是否被洗净的方法是______________________________
(4)将铜片放入浓氨水,无任何现象,加入一定量的H2O2后,铜片缓慢溶解,并形成深蓝色的溶液,写出相应的离子方程式: 。
2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1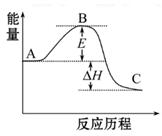
请回答下列问题:
(1)图中A、C分别表示_________、_________,E的大小对该反应 的反应热有无影响?_________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是__________________;(2)图中ΔH=_________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物VO2;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式_____________________________;
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3mol SO3(g)的ΔH_______(要求计算过程)。
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
⑤ |
⑥ |
||||||
| 3 |
① |
③ |
④ |
⑦ |
⑨ |
|||
| 4 |
② |
⑧ |
请回答:(1)形成化合物种类最多的元素是(填元素符号)。
(2)在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是(填化学式)。
(3)①、②、③三种元素按离子半径由大到小的顺序依次为(填离子符号)。
(4)⑥元素形成的具有强氧化性的氢化物结构式是 , 该元素另一种氢化物在常温下与②发生反应的化学方程式为。
某芳香烃A是有机合成中重要的原料,通过质谱法测得其相对分子质量为118,其苯环上只有一个取代基。以下是以A为原料合成化合物F和高分子化合物I的路线图,其中化合物F中含有三个六元环。试回答下列问题:
(1)E中官能团的名称为;
(2)I的结构简式为;
(3)写出反应③的化学方程式;
(4)写出反应⑤的化学方程式;
(5)写出所有符合下列要求的D的同分异构体的结构简式;
a.苯环上只有一个取代基; b.能与新制氢氧化铜悬浊液反应;
c.分子中—COO—含有结构。
2014年初雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g)  2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:
①该反应在能自发进行(填“高温下” 、“低温下” 或“任何温度下”);
②在T2温度下,0~2 s内的平均反应速率v(N2)=___________。
(2)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
在恒压下,将CH4(g)和NO2(g)置于密闭容器中,也可以发生化学反应:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
| A.增加原催化剂的表面积 | B.降低温度 |
| C.减小投料比[n(NO2) / n(CH4)] | D.增大压强 |
(3)在容积相同的两个密闭容器内 (装有等量的某种催化剂) 先各通入等量的CH4,然后再分别充入等量的NO和NO2。在不同温度下,同时分别发生上述的两个反应:并在t秒时测定其中NOx转化率,绘得图象如图所示:
从图中可以得出的结论是
结论一:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
推测原因是
结论二:
化合物甲是由短周期元素组成的陶瓷材料,是一种以共价键相连的物质,具有耐高温、抗冲击、导热性好等优良性质。乙是制备这种材料的起始原料,也是铝土矿的主要成分。制备时采取碳热还原氮化法,即把乙与炭粉按一定比例混合,在流动N2气氛中加热到一定温度即可得到甲和可燃性气体丙,二者原子个数之比均为1:1。8.2g甲与足量的氢氧化钠溶液混合可以得到无色溶液丁,并产生标准状况下4.48L气体戊。
(1)乙的化学式为,写出它的一种用途。
(2)甲的晶体类型为,写出碳热还原氮化法制甲的化学方程式。
(3)工业制备甲的过程中可能含有的杂质有。
(4)气体戊的结构式为,写出甲与足量的氢氧化钠溶液反应的化学方程式为,验证溶液丁中溶质的实验方法为。