在葡萄糖、蔗糖、麦芽糖、淀粉、纤维素中,属于单糖的是 ,属于多糖的是 ;本身能发生银镜反应的有 ;只有水解后才可以发生银镜反应的二糖是 。
X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,核电荷数按照Z、X、Y、W的顺序增大。已知Z的原子次外层的电子数为2,W、X原子次外层电子数为8。
(1)请写出元素Y的原子结构示意图:;其中元素W在周期表中的位置:。
(2)用电子式表示X与W形成化合物的过程: 。
。
(3)X、Y、Z、W的原子半径由大到小的顺序为:。(用元素符号表示)
(4)请写出W的单质与X的最高价氧化物对应水化物反应的化学方程式:
。
(5)元素X与元素Y相比,金属性较强的是(用元素符号表示),请举一例实验事实证明这一结论:
有A、B、C、D四种短周期元素, 它们的原子序数由A到D逐渐增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素符号: A ________ B __________ C __________ D ___________
(2)写出AB2的结构式为 ______________,C 2D的电子式
(3)画出D2-的离子结构示意图 ___________________
(1)以下每小题均有一对物质的名称,请将对应的序号填在括号里。
| A.同分异构体 | B.同位素 | C.同素异形体 | D.同系物 E.同种物质 |
①白磷和红磷()②35Cl和37Cl()
③正丁烷和异丁烷()④甲烷和丙烷()
(2)现有CH4、C2H2、C2H4、C2H6、C3H6五种有机物,相同状况同体积时,五种物质完全燃烧所消耗O2的量最多的是;生成的水最少的是。
某研究性学习小组在实验室合成了一种物质A。
(1)经分析,A的相对分子质量不超过100,A中C、H的质量分数分别为:w(C)=69.76%,
w(H)=11.63%,且完全燃烧后产物只有CO2和H2O。则A的摩尔质量为__________。
(2)A的核磁共振氢谱如下图所示,且A可以和金属钠反应生成H2,但不能在Cu作催化剂下被催化氧化。(提示:羟基与碳碳双键相连的结构不稳定)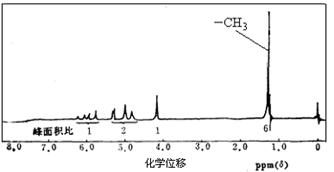
请根据以上信息写出A的结构简式。
(3)A的某种同分异构体B分子中不含支链,能发生银镜反应。
写出B发生催化氧化反应的化学方程式:。
(18分)镇痉药物C、化合物N以及高分子树脂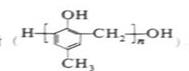 的合成路线如下:
的合成路线如下:
已知: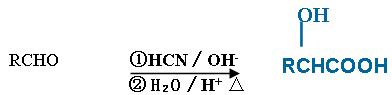
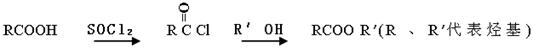
(1)A的含氧官能团的名称是 。
(2)A在催化剂作用下可与H2反应生成B。该反应的反应类型是 。
(3)酯类化合物C的分子式是C15H14O3,其结构简式是 。
(4)A发生银镜反应的化学方程式是 。
(5)扁桃酸(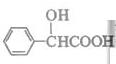 )有多种同分异构体。属于甲酸酯且含酚羟基的同分异构体共有 种,写出其中一种含亚甲基(―CH2―)的同分异构体的结构简式 。
)有多种同分异构体。属于甲酸酯且含酚羟基的同分异构体共有 种,写出其中一种含亚甲基(―CH2―)的同分异构体的结构简式 。
(6)F与M合成高分子树脂的化学方程式是 。
(7)N在NaOH溶液中发生水解反应的化学方程式是 。