为测写某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100mL0.3mol·L—1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560mL;再加0.2mol·L—1NaOH溶液至沉淀质量恰在此时好不再变化,用去350mL NaOH溶液。则所取样品中铝的物质的量为
| A.0.005mol | B.0.01mol | C.0.025mol | D.0.03mol |
下列各种变化中,不属于化学变化的是 ( )
| A.向鸡蛋溶液中滴入饱和硫酸钠溶液,析出白色沉淀 |
| B.加热胆矾得到白色的无水硫酸铜粉末 |
| C.向沸水中滴入饱和氯化铁溶液,制取氢氧化铁胶体 |
D.向鸡蛋白溶液中滴入硝酸铅溶液,析出白色沉 淀 淀 |
据报道,科学家已成功合成了少量的O4,有关O4的说法正确的是
| A.O4的摩尔质量是64 g |
| B.O4与O2互为同位素 |
| C.相同质量的O4与O3所含原子个数之比为1∶1 |
| D.O4与O3、O2都是氧元素的同分异构体 |
下列关于氧化物的叙述正确的是( )
| A.酸性氧化物都可以跟强碱溶液反应 |
| B.与水反应可生成酸的氧化物都是酸性氧化物 |
| C.金属氧化物都是碱性氧化物 |
| D.不能跟酸反应的氧化物一定能和碱反应 |
1体积乙烯与足量氯气发生加成反应,该加成产物与足量氯气发生完全取代反应(气体体积均在同温同压下测定),则至少消耗氯气
| A.3体积 | B.4体积 | C.5体积 | D.6体积 |
某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子数为
A.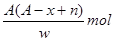 |
B.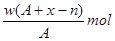 |
C.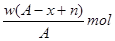 |
D. |