实验室可利用乙醇、铜或铜的化合物制备乙醛,下图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出)。试回答: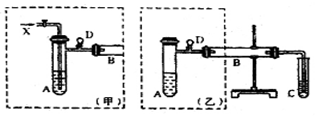
(1)在仪器组装完成后,加装试剂前必须要进行的操作是 ;
(2)两套装置中的A、B处都需加热,A处用水浴加热,B处用 加热,A处用水浴加热的主要优点是 。
(3)若按甲装置进行实验,B管处装铜粉,则通入A管的X是 ,B中反应的化学方程式为 。
(4)若按乙装置进行实验,则B管中应装 ,
B中反应的化学方程式为 。
(5)实验结束后,将C试管中的溶液滴入新制的氢氧化铜溶液中并加热,可观察到的
现象 ,写出该过程的化学方程式 。
(本小题共12分
 )某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹).
)某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹).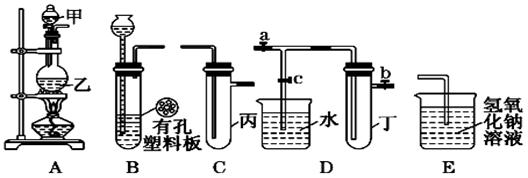
请按要求填空:
(1)利用B装置可制取的气体有______________________(写出两种即可).
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.
若在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实
验,实验操作、现象、结论如下:
| 实验序号 |
实验操作 |
现象 |
结论 |
| Ⅰ |
将氯水滴入品红溶液 |
溶液褪色 |
氯气与水反应的产物有漂白性 |
| Ⅱ |
氯水中加入碳酸氢钠粉末 |
 有无色气泡产生 有无色气泡产生 |
氯气与水反应的产物具有酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由________________
____________________________________________________________________.
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进行NO2有关实验.
①B中发生反应的化学方程式为________________________________ ______
______
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹___________,再打开止水夹_________,使烧杯中的水进入试管丁的操作__________________
____________________________________________________________________.
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的氧气,直到试管全部充满水,则所得溶液中溶质的物质的量浓度是______________________(气体按标准状况计算).
(10分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
(1)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是___________________________________________.
(2)①装置B中盛放的试剂名称为________,作用是____________________________,
现象是____________________________________________________________.
②装置 D和E中出现的不同现象说明的问题是_________________________________
D和E中出现的不同现象说明的问题是_________________________________
③装置F的作用是________________________________________________________.
④写出装置G中发生反应的离子方程式______________________________________
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在________与________之间(填装置字母序号),装置中应放入________(填写试剂或用品名称).
如图所示,把试管放人盛有25℃饱和石灰水的烧杯中,试管中开始放入固体试剂A,再在试管中用滴管滴入5 mL液体试剂B。可见到烧杯中饱和的澄清石灰水变浑浊。试回答下列问题:
(1)试推测试剂A和B各是什么?(不一定填满,最(最少2组)
| 固体试剂A |
液体试剂B |
|
| ① |
||
| ② |
||
| ③ |
||
| ④ |
(2)解释烧杯中澄清石灰水变浑浊的原因:。
实验室用如图所示装置制取并收集NO,请回答下列问题: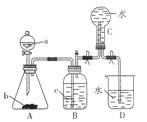
(1)仪器a的名称是。
(2)写出A中反应的化学方程式,其中HNO3表现的性质是,当有4molHNO3被还原时该反应中转移电子总数为。
(3)装置B的作用是
;
(4)A中产生的现象有。
下图是做过氨气溶于水的喷泉实验装置,实验完成后烧瓶里的空间被分为两个部分:A和B ,请根据实验内容按要求填空:
,请根据实验内容按要求填空: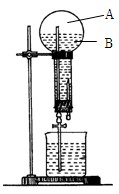
(1)A中的主要成分是;
(2)B中溶液即为氨水,把酚酞滴入氨水中,溶液显色,是因为(用离子方程式表示);
(3)试剂的滴加顺序不同,有时会产生不同的现象。
①把氨水滴入Al2(SO4)3溶液中,②把Al2(SO4)3溶液滴入氨水中,①、②的实验现象是否相同(填“相同”或“不同”),写出反应①的化学方程式;
反应②的离子方程式;
(4)把氨水滴加到FeSO4溶液中的现象为
。