下图是做过氨气溶于水的喷泉实验装置,实验完成后烧瓶里的空间被分为两个部分:A和B ,请根据实验内容按要求填空:
,请根据实验内容按要求填空: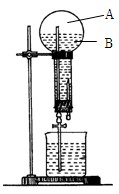
(1)A中的主要成分是 ;
(2)B中溶液即为氨水,把酚酞滴入氨水中,溶液显 色,是因为 (用离子方程式表示);
(3)试剂的滴加顺序不同,有时会产生不同的现象。
①把氨水滴入Al2(SO4)3溶液中,②把Al2(SO4)3溶液滴入氨水中, ①、②的实验现象是否相同 (填“相同”或“不同”),写出反应①的化学方程式 ;
反应②的离子方程式 ;
(4)把氨水滴加到FeSO4溶液中的现象为
。
在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中: ①为氯气发生装置;②的试管里盛有15mL 30% KOH 溶液.并置于热水浴中; ③的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④的试管里加有紫色石蕊试液; ⑤为尾气吸收装置。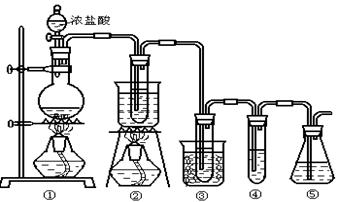
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过______(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_________(填写下列编号字母)的净化装置。
| A.碱石灰 | B.饱和食盐水 | C.浓硫酸 | D.饱和碳酸氢钠溶液 |
(2)比较制取氯酸钾和次氯酸钠的条件.二者的差异是。反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是(填写实验操作名称)。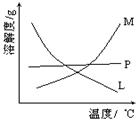
(3)本实验中制取次氯酸钠的离子方程式是:。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 |
原因 |
| 溶液最初从紫色逐渐变为色 |
氯气与水反应生成的H+使石蕊变色 |
随后溶液逐渐变为无色 |
______________________________________ |
| 然后溶液从无色逐渐变为色 |
_________________________________________ |
一定量的浓硫酸与足量Zn充分反应时有SO2和H2生成。某校化学研究性学习小组从定性方面对此作了研究。
按图组装好实验装置,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊,后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加。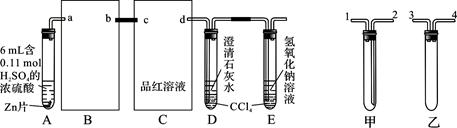
试回答下列问题:
(1)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接______、______接b,c接______、______接d;D、E两支试管中CCl4的作用是________________________。
(2)能证明浓硫酸具有强氧化性的实验现象为_______________________________;实验过程中,浓硫酸表现强氧化性的反应方程式是:
____________________________________________________________________
(3)反应较长时间后气泡量又会明显增加的原因是________________________________
____________________________________。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用下图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式:
______________________________________________________________
(2)饱和碳酸钠溶液的主要作用是_____________________________________________。
(3)若要把制得的乙酸乙酯分离出来,应采用的实验操作是_____________________。
用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3 g烧碱样品配制成250 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、胶头滴管外,还必须用到的仪器有。
(2)取待测液10.00 mL,用滴定管量取,并置于锥形瓶中。
(3)向锥形瓶中滴加几滴指示剂,用0.200 mol·L-1标准盐酸滴定待测烧碱溶液。不适宜选用的指示剂为(选填序号):________。①石蕊试液②无色酚酞③甲基橙试液
(4)根据两次滴定获得的实验数据如下表,得出烧碱的纯度为。
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
10.00 |
0.50 |
20.40 |
| 第二次 |
10.00 |
4.00 |
24.10 |
(5)下列操作中可能使所测烧碱溶液的浓度数值偏低的是(选填字母)。
A 酸式滴定管未用盐酸标准溶液润洗就直接注入盐酸标准溶液
B 锥形瓶用蒸馏水洗净后没有干燥就注入NaOH待测液
C 装有盐酸标准溶液的酸式滴定管在滴定前有气泡,滴定后气泡消失
D 读取HCl溶液体积时,开始仰视读数,滴定结束时俯视读数
E.若刚见到指示剂局部的颜色有变化就停止滴定
下图为苯和溴的取代反应的实验装置图,其中A为由具有支管的试管制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉。
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生有机反应的化学方程式:____________________________________________________________
(2)试管C中苯的作用是。反应开始后,观察D和E两试管,看到的现象为。
(3)反应2~3 min后,在B中的NaOH溶液里可观察到的现象是
。
(4)在上述整套装置中,具有防倒吸作用的仪器有(填字母):。