无水氯化镁是制备某种催化剂的中间体。某研究性学习小组设计实验方案进行制取无水氯化镁等实验。请填写下列空白。
[实验一]利用下图实验装置(夹持和加热装置省略),在HCl气流中小心加热MgCl2·6H2O晶体制取无水氯化镁(无水氯化镁易吸水)。烧瓶中发生的反应为:
NaCl+H2SO4(浓)===NaHSO4+HCl↑
(1)试剂X是 。第二个洗气瓶中的浓硫酸的作用是
(2)该实验装置存在一个缺陷是 。
[实验二]通过下列步骤,测定实验一所得产物中氯元素含量以确定产物是否含有结晶水:
①称取m1g样品置于烧杯中,充分溶解;
②加入足量硝酸银溶液,充分反应后,过滤;
③洗涤沉淀,干燥至恒重,称得沉淀质量为m2g。
(3)若步骤③的操作中未洗涤沉淀,将导致测得的氯元素含量 (填“偏高”或“偏低”)
(4)若测得m1=10.40,m2=28.70,则所得产品MgCl2·nH2O中n的值为 。
[实验三]一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如下对比实验:
| 实验序号 |
氯化镁固体中氯元素含量/% |
温度/℃ |
粉碎方式 |
催化效果/g·g-1 |
| 1 |
70.97 |
20 |
滚动球磨 |
3.9×104 |
| 2 |
74.45 |
20 |
滚动球磨 |
5.0×104 |
| 3 |
74.45 |
20 |
振动球磨 |
5.9×104 |
| 4 |
ω |
100 |
振动球磨 |
|
注:催化效果用单位时间内每克催化剂得到产品的质量来表示
(5)表中ω= 。
(6)从实验1、2可以得出的结论是 。
(7)设计实验2、3的目的是 。
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图。加热聚丙烯废塑料得到的产物如下表:
| 产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
| 质量分数(%) |
12 |
24 |
12 |
16 |
20 |
10 |
6 |
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
写出反应②③的化学方程式:______________________、___________________________。
(2)试管B收集到的产品中,能使高锰酸钾酸性溶液褪色的物质,其一氯代物有_______________种。
(3)锥形瓶C中观察到的现象____________________________________________________。
经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为___________。
(4)写出C中逸出的气体在工业上的两种用途:______________________________________、_________________________________________________。
实验室配制480 mL 0.1 mol·L-1Na2CO3溶液,完成下列问题:
(1)应用托盘天平称取无水碳酸钠粉末__________g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠粉末是__________g(1 g以下用游码)。
(3)配制Na2CO3溶液时需用的主要仪器有__________、__________、__________、__________、__________。
(4)使用容量瓶配制溶液时,下列情况会使所配溶液浓度偏低的是__________。
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了②无水碳酸钠粉末已部分吸水变成晶体③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤④转移溶液前容量瓶内有少量蒸馏水⑤定容时,俯视容量瓶的刻度线⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
Ca3(PO4)2、CaHPO4均为难溶于水的白色固体。某同学向Na2HPO4溶液中滴加CaCl2溶液至恰好反应,生成了白色沉淀。试设计一个简单的实验方案,来证明所生成的白色沉淀是Ca3(PO4)2还是CaHPO4。
实验原理:______________________________
实验用品及试剂:试管、胶头滴管、_______________________________
实验步骤、现象、结论(可不填满)
①_________________________________;②_______________________________;
③_________________________________;④_______________________________。
设计实验证明盐酸和NaOH溶液发生了反应。学生提出了许多有创意的想法:①用酸碱指示剂监测,②用pH试纸监测,③利用导电实验测定离子浓度的变化,④将盐酸和碱液混合后的溶液蒸干后品尝味道。请对上述创意作出评判后回答下列问题:
⑴在想法①中,如果是将NaOH溶液滴入盐酸中,可以在盐酸中先加几滴____(填一种酸碱指示剂的名称),再不断滴入NaOH溶液,颜色由___变_____。
⑵在想法②中,写出测定pH的基本操作:____________________。
⑶在想法③中,如用浓度均为1mol/L的盐酸和NaOH溶液进行实验,简述实验的操作步骤,并说明是如何判断盐酸与NaOH溶液发生了反应。
⑷对第④中设计,提出你的看法?
⑸你能否提出其它一些有创意的想法。
设计一个实验,能通过观察到明显的现象,说明CO2与NaOH溶液发生了反应。实验用品:集气瓶、烧瓶、分液漏斗、长颈漏斗、导管、橡皮管、弹簧夹、烧杯、量筒、水、CO2气体、NaOH溶液以及你认为所能用到的仪器和药品。现有五位学生装设计了如图所示五个装置,试回答:
(A)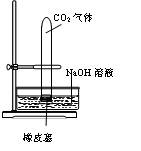 (B)
(B)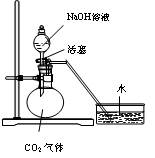
(C)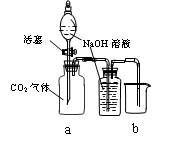 (D)
(D)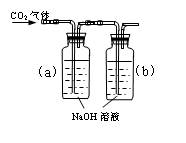
(E)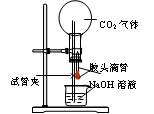
⑴对图A-E,请指出能达到实验目的的装置_______(用A、B、C、D、E填空),并说明能证明CO2与NaOH溶液发生了反应的操作及实验现象,将结果填入下表:
| 装置 |
实验方法 |
实验现象 |
⑵能否设计出其它一些方法来证明CO2与NaOH溶液发生了反应。