Ca3(PO4)2、CaHPO4均为难溶于水的白色固体。某同学向Na2HPO4溶液中滴加CaCl2溶液至恰好反应,生成了白色沉淀。试设计一个简单的实验方案,来证明所生成的白色沉淀是Ca3(PO4)2还是CaHPO4。
实验原理:______________________________
实验用品及试剂:试管、胶头滴管、______________________ _________
实验步骤、现象、结论(可不填满)
①_________________________________;②_______________________________;
③_________________________________;④_______________________________。
(I) 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1) 写出该反应的化学方程式。
(2) 检验溶液中Fe3+存在的试剂是,证明Fe3+存在的现象是。
(Ⅱ) 印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。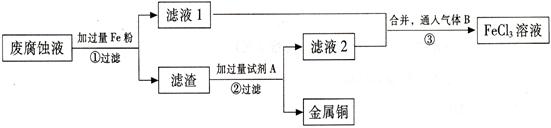
⑴ 步骤①中发生反应的离子方程式。
(2) 步骤②需加入的试剂A是(填化学式)。
(3) 步骤③通入的气体B是(填化学式),写出该反应的化学方程式。
(4) 为测定滤渣中铜的质量分数,取50g的滤渣与足量的试剂A反应,得到5.6L气体(标准状况下),试计算滤渣中铜的质量分数。
混合物A中含有KAl(SO4)2·12H2O、Al2O3和Fe2O3,通过下图所示方法可分离回收Al2O3和Fe2O3:
回答下列问题:
(1) 滤渣Ⅰ的主要成分是(填化学式)。
(2) 为了使滤渣Ⅰ中某些成分溶解,便于分离出Fe2O3,所加入的试剂Ⅰ是(填化学式),发生反应的离子方程式是:。
(3) 向滤液Ⅰ中加入过量氨水可得到白色沉淀,反应的离子方程式是:。
(4) 滤渣Ⅲ的主要成分是(填化学式);滤渣Ⅲ在一定条件下反应生成 Al2O3,反应的化学方程式是。
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应)。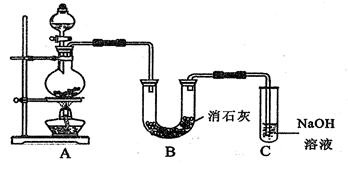
据此回答下列问题:
(1) 在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,若在标准状态下收集到33.6L的氯气,则被氧化的HCl的物质的量是。
(2) 漂白粉将在U形管中产生,其化学方程式是。
(3) C装置的作用是。
(4) 此实验所得漂白粉的有效成分偏低。该学生经分析并查阅资料发现,主要原因是在U
形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措
施是。
② 试判断另一个副反应为(用化学方程式表示)。
为避免此副反应的发生,可将装置作何改进。
(5) 家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是( )
| A.食盐 | B.食醋 | C.烧碱 | D.纯碱 |
氯气是一种重要的化工原料,在生产和生活中的应用十分广泛。
(1)请写出实验室用二氧化锰和浓盐酸共热制取氯气的化学方程式。
(2)实验室欲制得氯气1.12 L,理论上需要消耗二氧化锰多少克?
(3)①若用3.36 L 氯气与4.0 mol/L的NaOH溶液反应制取简易消毒液,则需要多少毫升这种NaOH溶液能与氯气恰好完全反应?
②实验发现,该反应产物的质量明显小于理论值,可能的原因是
。
实验室用Na2CO3固体配制250 mL 0.1 mol/L的Na2CO3溶液。请填写下列空白:
(1)实验时,应用托盘天平称取Na2CO3固体g。
(2)在配制Na2CO3溶液时需用的玻璃仪器主要有量筒、烧杯、玻璃棒、、
。
(3)实验中两次用到玻璃棒,其作用分别是___________、__________。
(4)若实验过程中遇到下列情况,则会造成所配溶液浓度偏低的有_____。(填序号)
| A.转移前,容量瓶中含有少量蒸馏水 |
| B.转移时,有少量溶液溅出 |
| C.定容时,仰视刻度线 |
| D.定容时,俯视刻度线 |