(17分)有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,E是_________。
(2)写出C元素基态原子的电子排布式_________________________。
(3)B 、D两种元素的氢化物中,沸点大的是 (写化学式号),其原因是
(4)元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填“>”、“<”或“=”,用元素符号表示)
(5)E位于周期表的第 周期,第 族;其原子结构示意图为 。
(6)A与B形成的A2B2化合物含 键(填“极性”或“非极性”),属 分子。(填“极性”或“非极性”)其电子式为:______________________________。
某无色溶液可能含有Na+、Ba2+、NH4+、CO32-、SO32-、NO3-、SO42-、I-等离子。为鉴定这些离子,分别取少量溶液进行以下实验:
①取样品进行焰色实验,焰色呈黄色;
②取样品加BaCl2溶液,立即产生白色沉淀。过滤后,向白色沉淀中加入足量盐酸,沉淀部分溶解;
③取样品加入少量淀粉溶液,再加入过量氯水,无明显现象;
④取样品加入足量稀H2SO4,生成无色气体。该气体不能使澄清石灰水溶液变浑浊,但遇空气后立即变成红棕色;
分析上述4个实验,回答下列问题。
(1) 该溶液中肯定不含的离子是,不能确定的离子是;
(2) 写出第④步中加入稀H2SO4生成气体的离子方程式;
(3) 设计实验检验第(1)题中不能确定的离子:取样品于试管中,
,则说明含有该离子。
某无色溶液中只可能含有NH4+、K+、Al3+、Fe3+、Cl-、SO42-等离子中的几种离子。
①该溶液的焰色反应呈现出紫色。
②取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀,向滤液中加入AgNO3溶液未见沉淀产生。
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后沉淀完全溶解。并且随NaOH溶液的加入,沉淀和气体的变化关系如下图所示。
(1)该溶液中一定含有(填离子的化学式)离子,一定不含有的离子有(填离子的化学式);
(2)①根据图中所示数据,计算实验中使用的NaOH溶液的物质的量浓度
为:
②在配制实验所需100mL NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需
要(填仪器名称)。
(3)根据图示信息分析该溶液中焰色反应呈现紫色的离子的物质的量浓度为:
甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体。X、Y、Z是化合物。X溶液呈淡绿色,Y、Z的溶液都能使KSCN溶液变红。它们之间有如下图所示转化关系。
请回答:
(1)将Y的饱和溶液滴入沸水中,继续加热可得红褐色液体,此液体不具有的性质是
A. 光束通过该液体时形成光亮的“通路”
B. 插入电极通过直流电后,有一极附近液体颜色加深
C. 向该液体中加入硝酸银溶液,无沉淀产生
D. 将该液体加热蒸干、灼烧后,有氧化物生成
(2)①单质甲、乙和Y溶液中的阳离子氧化性由强到弱的顺序为:(用化学式表示)
②少量单质甲通入X溶液中发生的离子方程式为
(3)实验室制备、收集纯净干燥的甲单质,所需仪器如下,装置A为发生装置;除装置A中所需的药品外,其他装置中供选择的药品有:浓硫酸、碱石灰、五氧化二磷、饱和食盐水、氢氧化钠溶液。
①装置A中发生反应的化学反应方程式:
②按气流的方向连接各仪器接口,顺序为
a→→→→→f。
③指出装置B、C、E中的药品(从提供的药品中选择):
B:C:E:
某有机物X是农药生产中的一种中间体,其结构简式为:
(1)X的分子式为_____________________________________。
(2)X分子中含有的官能团有________(用结构简式或名称表示均可)。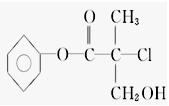
(3)X可能发生多种反应,下列有关X发生化学反应的叙述中正确的是________。
A.在氢氧化钠醇溶液中共热能发生 消去反应; 消去反应; |
| B.在铜作催化剂时加热,可被氧气氧化生成能发生银镜反应的物质; |
| C.在浓硫酸存在时加热可发生消去反应; |
| D.在铁作催化剂时,可跟液溴发生取代反应; |
(4)写出X跟氢氧化钠稀溶液共热时所发生反应的化学方程式________________。
(5)X可能有多种同分异构体,写出符合下列条件的一种同分异构体的结构简式:
。
①苯环只有分子处在对位的两个取代基。
水是自然界中普遍存在的一种物质,也是维持生命活动所必需的一种物质。
信息一:水的性质存在许多反常现象,如固态密度小于液态密度使冰浮在水面上,沸点相对较高使水在常温常压下呈液态等。
信息二:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如下图):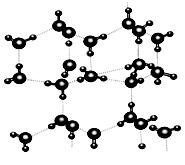
试根据以上信息回答下列问题:
(1)s轨道与s轨道重叠形成的共价键可用符号表示为δs-s,p轨道以“头碰头”方式重叠形成的共价键可用符号表示为δp-p,则H2O分子中含有的共价键用符号表示为:。
(2)位于第四周期,与氧元素同主族的元素名称是:;其外围电子排布式是:。
(3)下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是:。
| A.金刚石 | B.干冰 | C.食盐 | D.固态氨 |
(4)已知:2H2O  H3O++OH-,H3O+的立体构型是,H3O+中含有一种特殊的共价键叫做。
H3O++OH-,H3O+的立体构型是,H3O+中含有一种特殊的共价键叫做。
(5)根据等电子原理,写出短周期元素原子形成的与H3O+互为等电子体的分子或离子________。
(6)水的分解温度远高于其沸点的原因是:
________________________________________________________________________