下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)。
| |
I1 |
I2 |
I3 |
I4 |
…… |
| R |
740 |
1 500 |
7 700 |
10 500 |
…… |
下列关于元素R的判断中一定正确的是
A.R的最高正价为+3价
B.R元素位于元素周期表中第ⅡA族
C.R元素的原子最外层共有4个电子
D.R元素基态原子的电子排布式为1s22s2
一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g);△H>0。现将1molA和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);△H>0。现将1molA和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是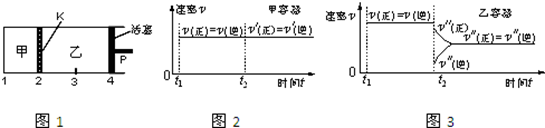
| A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中 C的浓度的2倍 |
| B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 |
| C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
| D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
下列图示与对应的叙述不相符的是



图1图2图3图4
| A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| C.图3表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1醋酸溶液得到的滴定曲线 |
| D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化 |
已知HA的酸性比HB的酸性强。现有物质的量浓度和体积均相同的NaA和NaB两种溶液,已知前者溶液中离子数目为n1,后者溶液中离子数目为n2。下列关系正确是
| A.n1=n2 | B.n1>n2 |
| C.n1<n2 | D.c(A—)<c(B—) |
用质量均为100 g的铜作电极,电解AgNO3溶液,电解一段时间后,两极质量相差28 g,此时阳极质量为
| A.121.6 g | B.86 g | C.93.6 g | D.89.6 g |
反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是
A. |
B.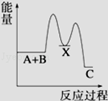 |
C.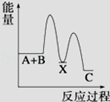 |
D. |