(1)等物质的量的NO2和N2O,在标准状况下的体积之比 ,所含O原子个数之比 ,二者的质量之比 。
(2)同温、同压下,等质量的CH4、H2、O2、N2四种气体,体积最大的是_ _ __,分子数 最多的是___ _,密度最大的是__ __,原子数最多的是__ __。(填化学式)
最多的是___ _,密度最大的是__ __,原子数最多的是__ __。(填化学式)
(3)NaCl、MgCl2、AlCl3三种溶液,若物质的量浓度相同,则三种溶液中氯离子的物质的量浓度之比为 ;若体积相同、物质的量浓度之比为1∶2∶3,则三种溶液中氯离子的物质的量浓度之比 ;若体积相同、物质的量浓度相同的AgNO3溶液,与等浓度上述三种溶液恰好反应,则消耗三种溶液的体积之比为 。
在物理和化学中,有些原理、定律具有相似性。如物理中有机械守恒定律,化学中有质量守恒定律。比较它们有助于我们的学习。
(1)1834年,物理学家楞次(1840年—1865年)概括了各种实验结果,得到如下结论:感应电流具有这样的方向,就是感应电流的磁场总要阻碍引起电流的磁通量变化。这就是楞次定律。请写出与楞次定律相似的化学原理或定律:______________________________;
其内容是_______________________________________________________________________
____________________________________________________________________________。
(2)在物理学的匀变速直线运动中常用图来分析速度、时间和位移相当于如图甲中阴影部分所占的面积。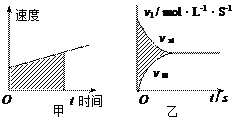
现在容积为2L的密闭容器中进行某一可逆反应: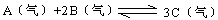 ,其中B物质的正反应速率
,其中B物质的正反应速率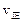 逆反应速率
逆反应速率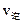 随时间变化的关系如右图乙所示,则图中阴影部分的面积表示的意义为:___________________
随时间变化的关系如右图乙所示,则图中阴影部分的面积表示的意义为:___________________
已知Cu(OH)2沉淀在一定的条件下可以溶解在氨水中,有关反应的化学方程式为:Cu(OH)2+4NH3·H2O [Cu(NH3)4]2++2OH-+4H2O,有下列实验操作:
[Cu(NH3)4]2++2OH-+4H2O,有下列实验操作:
(1)操作1:在盛有3 mL 0.1 mol·L-1 CuSO4溶液的试管中滴加3 mL 0.2 mol·L-1 NaOH溶液,结果出现蓝色的悬浊液,有关反应的离子方程式为___________。
(2)操作2:在盛有3 mL 0.1 mol·L-1 CuSO4溶液的试管中滴加3 mL 0.2 mol·L-1氨水,结果也出现蓝色的悬浊液,有关反应的离子方程式为___________。
(3)在上述两种悬浊液中分别加入2 mol·L-1的氨水溶解,请从平衡移动的角度思考哪一种悬浊液更易溶解成为清液?__________(填“操作1”或“操作2”);理由是_____________。
(4)请你设计一个简单的实验方案验证上述观点(或理由)的可靠性。实验方案:______。
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10l kPa,温度为0℃)。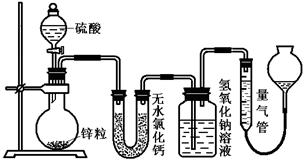
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_____________ 。
A.200 mL B.400 mL C.500mL
(2)若1.30g锌粒完全溶解,测得盛氢氧化钠溶液的洗气瓶增重l.28 g ,则圆底烧瓶中发生反应的化学方程式为:_______________________________________。
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g量气管中收集到VmL气体,则有方程:a g/65g·mol-1=b g/64g·mol-1+V mL / 22400 mL·mol-1,其依据的原理是____________________________。
(4)若在烧瓶中投入d g锌,再加入V L c mol/L 浓硫酸,充分反应后锌有剩余,测得盛氢氧化钠溶液的洗气瓶增重m g,则整个实验过程产生的混和气体中H2和SO2物质的量之比 n(H2)/n(SO2)=_______________(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,n(H2)/n(SO2)的比值将(填
偏大、偏小或无影响)
正常人血液中葡萄糖(简称血糖)为3.61~ 6.11(单位:mmol·.L―1),测得某人血液中血糖的质量分数0.1%,已知葡萄糖的相对分子质量为180设血液密度为1g·cm―3,通过计算判定某人血糖指标是多少?某人血糖是否正常?
(7分) 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):



(1)判断BaCl2已过量的方法是_________________________________。
(2)第④步中,有关的离子方程式是_____________________________。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是
_____________________________。
(4)为检验精盐纯度,需配制1000mL.0.2 mol/L NaCl(精盐)溶液,若定容时观察液面仰视(如右图所示),会造成所配制的溶液浓度(填偏高或偏低 )________________。