(14分)化合物A(C8H8O3)为无色液体,难溶于水,有特殊香味,从A出发,可发生图示的一系列反应,图中的化合物A苯环上取代时可生成两种一取代物,化合物D能使FeCl3溶液显紫色,G能进行银镜反应。E和H常温下为气体。试回答: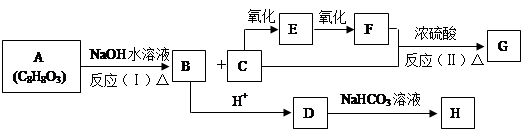
(1) 写出下列化合物的结构简式:
A: ;B: ;G:
(2)C中的官能团名称为
(3)反应类型:( I ) ;(Ⅱ) 。
(4) 写出D→H的化学方程式: 。
Ⅰ、物质的分离和提纯有多种方法。物质分离、提纯方案的设计在科学研究和工业生产中占有十分重要的地位。工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、SiO2等,已知SiO2是不溶于水的酸性氧化物,Fe2O3是不溶于水的碱性氧化物)。某研究小组设计的提纯Al2O3的方案如下:
(1)写出沉淀A的化学式:___________________________________________________。
(2)加入过量的NaOH溶液,过滤后的滤液中含有的溶质有________________________。
(3)写出由沉淀A—→Al2O3的化学方程式:________________________,通入过量CO2生成沉淀A时反应的离子方程式为_______________________________________________。
Ⅱ、按照要求回答下列问题:
A、B、C、D、E是常见化合物或单质,有如下转化关系 (略去条件和副产品)。
(1)若A为黄绿色气体单质,D、E为生活中常见的两种金属,其中E是一种红色光亮的物质。
① 写出向B的溶液中加入足量D的离子反应方程式_____________________________________。
②向①所得的溶液中加入NaOH溶液,并在空气中放置的现象是:_________________________,写出固体在空气中放置的化学反应方程式:__________________________________________。
(1)配平该反应并标出电子转移的方向和数目:KMnO4+HCl = MnCl2+ KCl+ Cl2↑+ H2O
(2)氧化剂是________________,氧化产物是__________________(填化学式)。
(3)若生成71 g Cl2消耗的HCl是___________________,被氧化的HCl是_______________。
(4)CS2(液体)能在O2中完全燃烧,生成CO2和SO2,若将0.1 mol CS2在1 mol O2中完全燃烧,所得混合气体在标准状况下所占的体积为__________L。
Ⅱ、(6分)(1)下列A. B. C. D 是中学常见的混合物分离或提纯的基本装置
请根据实验需要将A. B.C. D装置填入适当的空格中。
①分离汽油和氯化钠溶液____________________
②用自来水制取蒸馏水__________________
③除去粗盐溶液中悬浮的泥沙_______________________________
(2)检验Fe3+常用的试剂除碱外,还可以将KSCN溶液滴入待检测溶液中,其产生的现象是______
________________________,发生反应的离子方程式________________________________。
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O,工艺流程如下(部分操作和条件略):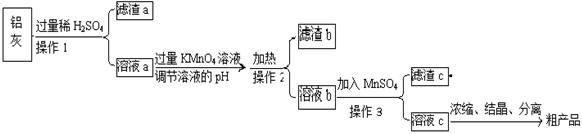
(1)滤渣a可用于制造
(2)请将MnO4-氧化Fe2+的离子方程式补充完整:
若反应中转移了2mol电子,则消耗氧化剂的物质的量为 mol。
(3)已知生成氢氧化物沉淀的pH如下:
| Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
调节溶液pH约为3的目的是: 。
(4)取少量滤渣C于试管中,加入适量的双氧水,产生能使带火星小木条复燃的气体,说明滤渣C的主要成分是 。请写出加入MnSO4时所发生反应的离子方程式: 。
(5)A12(SO4)3·18H2O溶于水溶液呈酸性的原因: 。(用离子方程式表示)
置换反应可用下图表示,回答下列问题:
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为。
(2)若过量单质甲与化合物A发生反应现象为溶液由蓝色变为浅绿色, 除去反应后混合物中剩余的甲所用的试剂名称是写出单质甲与化合物A反就的离子方程式。
(3)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式
(4)若单质乙是红色金属固体单质,化合物B常温下为无色液体,则该反应的化学方程式为。
A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,K、L是无色气体,且K是非极性分子,F、H是黑色晶体。以上物质相互间的转化关系如下图所示:
请回答下列问题:
(1)元素A的核外电子排布式为________________。
(2)D能与氢氧化钠溶液反应,请写出该反应的离子方程式___________________。
(3)写出A与G反应的化学方程式_______________________________________。
(4)写出H和D反应的化学方程式______________________________________。
(5)写出K与E反应的化学方程式_________________________________________。