请利用下列装置及试剂组装一套装置。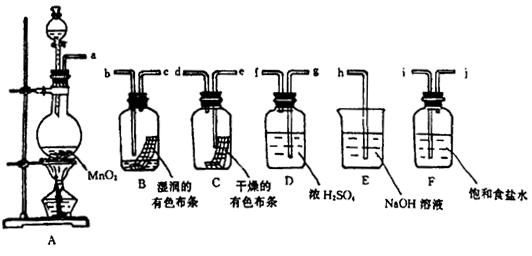
其流程是,先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。
(1)按气体从左向右流向将各装置依次连接起来(填字母序号):
a接____ _____ 接 ___________接_____________接______ _______ 接h。
(2)烧瓶中发生反应的化学方程式是 。
(3)E装置的作用是 ,F装置的作用是 。
(4)C瓶中的现象是 ,B瓶中的现象是 。以上事实说明起漂白作用的物质是 。
某实验小组想验证Mg粉和CO2的反应,请从下图中选用所需的仪器(可重复选用)组成一套进行该实验的装置。现提供浓H2SO4、稀盐酸、镁粉、大理石、澄清石灰水,饱和NaHCO3溶液、饱和Na2CO3溶液。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)。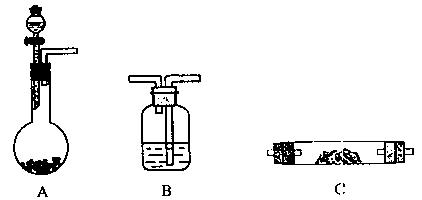
(1)将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加的试剂(可不填满)
| 选用的仪器(填字母) |
加入的试剂 |
| A |
稀盐酸、大理石 |
(2)A中发生反应的离子方程式为。
(3)组装好仪器,检查气密性良好,加入药品。在加热反应管C之前应进行的操作和目的是
。
(4)反应中C装置的主要现象是。
(1)配制 1 mol/L的CuSO4溶液500ml,需胆矾① g;用托盘天平称出,把称好的胆矾放入② 里,用适量蒸馏水使它完全溶解,把制得的溶液小心地转移到③中,用适量蒸馏水洗涤烧杯、玻璃棒2~3次,把每次的洗涤液都注入④ 中,然后慢慢地加入蒸馏水到液面在刻度线下⑤ ,改用⑥ 滴加蒸馏水到刻度,使溶液的⑦ ;把瓶塞盖好,用⑧ 顶住瓶塞,另一只手⑨ ,将瓶底倒转、摇匀。
(2)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不变”)
①定容时俯视容量瓶的刻度线。
②如果加水超过了刻度线,取出水使液面恰好到刻度线。
(8分)氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现有0.001mol/L酸性KMnO4和未知浓度的无色NaHSO3溶液,反应离子方程式是2MnO4- + 5HSO3- + H+ ==2Mn2+ + 5SO42-+ 3H2O填空回答问题:
(1)该滴定实验所需仪器有下列中的______________________________(填序号)
| A.酸式滴定管 | B.碱式滴定管 | C.量筒 | D.锥形瓶E.铁架台F.滴定管夹G.烧杯H.白纸I.胶头滴管J.漏斗 |
(2)滴定前平视KMnO4溶液,刻度为a mL,若滴定后(终点)俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积_________( 多、少)。根据(b-a)mL计算得到的待测液浓度比实际的浓度_________(大、小)。
下列实验中,不能达到预期的目的的是(填选项编号)
| A.用升华法分离碘和苯的混合物 |
| B.用分液法分离水和硝基苯的混合物 |
| C.将甲烷与氯气混合光照制二氯甲烷 |
| D.用电石和饱和食盐水制乙炔 |
E. 用酒精和浓硫酸混合加热至170℃制乙烯
下图为学生设计的制取溴苯的装置。
(1)图中的错误之处有处。
(2)往烧瓶中依次加入铁粉、苯和。
(3)与烧瓶中连接的垂直向上的导管的作用是。
(4)烧瓶中发生反应的化学方程式为_______________。
(5)反应完毕后,向锥形瓶中的溶液中滴入AgNO3溶液,现象为。
(6)反应完毕后,将烧瓶中橙红色的液体倒入盛有足量Na OH的烧杯中,充分振荡,静置,分液得无色油状产品,写出离子方程式。