氮是地球上含量丰富的一种元素,氮元素的
单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据右侧能量变化示意图,请写出NO2和CO反应
的热化学方程式 。
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g) △H < 0 ,
2NH3(g) △H < 0 ,
其平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
①该反应的平衡常数表达式:K=
②试判断K1 K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)对反应N2O4(g) 2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是 。
2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是 。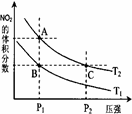
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)= , 以NH3表示该过程的反应速率v(NH3)= 。
某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A露置在空气中足够长时间变为C,B和酸性气体D能生成C,A和B都能与水生成E,E和D也能生成C。回答下列问题。
(1)写出下列物质的化学式:C,D,E。
(2)写出下列反应的化学方程式:
A和水生成E:。
②B和D生成C:。
③Cl2与E的水溶液:。
短周期的四种主族元素W、X、Y、Z,原子序数依次变小,四种元素的原子核外电子层数之和为8。X元素的原子最外层电子数等于Y和Z两元素的原子最外层电子数之和。W元素和Y元素的原子最外层上的电子数分别是各自电子层数的2倍。X和Z可以形成XZ3的气态化合物。
(1)写出元素名称:W__________,X____________,Y__________,Z__________。
(2)(XZ4)2W属于离子化合物,写出此化合物的电子式_________________。
(3)A物质是一种酸,它的一个分子里含有一个W原子,一个X原子,一个Y原子和一个Z原子,四个原子共形成五对共用电子对,请写出该物质的结构式__________。A物质的钾盐溶液常用检验_________(填写一种阳离子符号)。
(4)已知W、X、Y、Z四种元素可两两组成多种微粒,请写出其中所含电子数均为10的三种微粒______________________________________。
人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
负极反应式为。
正极反应式为。
(2)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为,若将此反应设计成原电池,则负极所用电极材料为,正极反应式为。
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为。
| A.铝片、铜片 | B.铜片、铝片 | C.铝片、铝片 | D.铜片、铜片 |
写出插入烧碱溶液中形成原电池的负极反应式:。
(4)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是__________(填“a”或“b”),该极的电极反应式是:________________。
②电池工作一段时间后电解质溶液的pH_________(填“增大”、“减小”或“不变”)。
表是元素周期表的一部分。(注意:以下各空请用化学术语答题,不能用字母代替)
| 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O族 |
| 1 |
||||||||
| 2 |
G |
H |
D |
|||||
| 3 |
B |
C |
E |
|||||
| 4 |
F |
A |
(1)A~H八种元素中:
a.原子半径最小的元素对应的单质是,还原性最强的单质是。
b.最高价氧化物对应的水化物酸性最强的酸的化学式是。
(2)C元素的离子结构示意图,用电子式表示AD2的形成过程。
(3)G元素的最高价氧化物的电子式。
(1)现有下列物质:①O2②Na2O2③Ca(OH)2④NH3⑤H2O2⑥CaCl2⑦NH4Cl。由离子键和非极性键构成的物质是_____,只由极性键构成的物质是_____,由极性键和非极性键构成的物质是_____,由离子键和极性键构成的物质是_____,属于共价化合物的是_____。
(2)相同质量的D2O和H2O中质子数之比是________;相同物质的量的D2O和H2O中中子数之比是________。