实验题:(1 8分,每空2分)
8分,每空2分)
Ⅰ部分:
甲、乙、丙三位同学分别用如下实验装置及化学药品(碱石灰为氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答问题:
(1)他们制取氨气的化学方程式为: 。
(2)三位同学都用向下排空气法收集氨气,其原因是 。
(3)三位同学用 上述装置制取氨气时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨气的同学是___填(“甲”、“乙”或“丙”)。
上述装置制取氨气时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨气的同学是___填(“甲”、“乙”或“丙”)。
(4)检验氨气是否收集满的方法是:(简述操作方法、现象和结论)

(5)三位同学都认为他们的实验装置还可用于加热碳酸氢铵固体来制取纯净的氨气,你判断能够达到实验目的的是________(填“甲”、“乙”或“丙”),该装置中的NH4HCO3固体能否用NH4Cl固体代替?____ (填“能”或“不能”)。
Ⅱ部分
已知二氧化硫可使高锰酸钾溶液褪色反应的化学方程式为:
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
右图为验证浓硫酸与木炭在加热条件下,反应产物中是否含有SO2和CO2的部分装置。
(6)实验时,从 端连接盛有澄清石灰水的实验装置(用a或b 填空)。
(7)可观察到A瓶溶液 。
(8)C瓶溶液的作用是 。
(原创)重庆一中某化学兴趣小组,欲在常温常压下,用一定质量的铜镁合金与足量稀盐酸反应,利用下图装置,测定样品中铜的质量分数。
A B C
(1)实验反应原理:写出镁与稀盐酸发生反应的化学方程式________________
(2)仪器识别:写出上图中仪器①、②的名称:①_________②__________
(3)装置连接:a→___________→___________→d
(4)A中反应已经进行完毕的现象为__________________________
(5)实验中,该兴趣小组同学测得以下数据
a.反应前样品铜镁合金的质量,记为m1 g
b.反应结束后,经过处理后的残余固体的质量,记为m2 g
c.经过一系列正确的操作后,读取量筒中的水的体积,记为V mL
d.查阅资料,常温常压下,H2的密度为ρ g/L
四位同学分成甲、乙两个小组,甲组同学利用重量法为思路,请合理选择以上数据,列式求铜的质量分数:________×100%;乙组同学利用排水法测量气体体积为思路,请合理选择以上数据,列式求铜的质量分数:________×100%
(6)误差分析环节中指导教师提出,甲、乙两组同学的思路中,会有很多因素导致测得的铜的质量分数出现误差,现将可能导致误差的因素罗列如下,并回答相关问题
a.读取量筒中水的体积时,未等装置中气体恢复至室温
b.读取量筒中水的体积时,俯视量筒
c.实验开始前,没有检查装置气密性,然而装置实际是漏气的
d.B瓶中残留的空气的干扰
e.未除去样品铜镁合金表面的氧化膜便进行称量
f.未对反应中挥发出的HCl气体进行除杂处理
g.未对反应后剩余的残余物进行洗涤
h.未考虑B、C装置间连接导管中残留的水
导致铜的质量分数大于理论值的原因可能是___________________(填符号a~h)
导致铜的质量分数小于理论值的原因可能是___________________(填符号a~h)
(原创)海洋中含有丰富的宝贵资源,除了制备粗盐,还可以提取碘,冶炼金属镁等。
I.海藻中含有丰富的碘元素,碘元素以I﹣的形式存在,Cl2可以将I﹣氧化得到碘单质,实验室从海藻中提取碘单质的实验流程如下:
(1)请写出相关操作的名称:①_____________________;③_______________________
(2)如果要求有色层在上层,可以选择_______________试剂进行碘单质的萃取(填字母)
| A.醋酸 | B.苯 | C.四氯化碳 | D.汽油 |
(3)实验中的“后期处理”主要是指分液和蒸馏,蒸馏采用实验装置如下图所示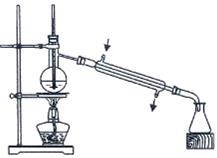
此图中的错误共有_________处(填数字)
II.海水经淡化可获得淡水和浓海水,浓海水中主要含有离子Na+、Mg2+、Cl﹣、SO42﹣。从浓海水中提取金属镁的一般工艺流程如下: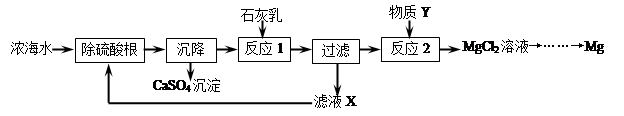
(1)补全由贝壳(主要成分为碳酸钙)生产石灰乳的相应转化中所需的条件或反应物: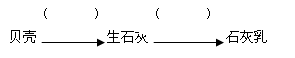
(2)写出反应2的化学方程式: 。
(3)操作流程中可循环使用的滤液X中的物质是 (填化学式)。
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解。在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。
步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B 的烧杯中应加入的溶液是 ;冷凝管中冷却水从 (填“a”或“b”)口进水。
(2)A中多孔球泡的作用是 。
(3)冷凝管中回流的主要物质除H2O 外还有 (填化学式)。
(4)写出步骤2中发生反应的化学方程式 。
(5)步骤3中在真空容器中蒸发浓缩的原因是 。
(6)为了测定产品的纯度,准确称取2.0g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,则所制得的产品的纯度为 。
硫代硫酸钠又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图所示
已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na2S2O3·5H2O装置和部分操作步骤如下:
步骤1:如图连接好装置后, ,将D中导管末端浸入水中,微热烧瓶观察气泡和水柱检查装置A、C、D气密性。
步骤2:加入药品,打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。装置B中的药品可选用下列物质中的。
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.饱和NaHSO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少,当C中溶液的pH接近7时,打开K2,关闭K1即停止C中的反应,停止加热。“当C中溶液的pH接近7时即停止C中的反应”的原因是______________________(用离子方程式表示)。
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液冷却结晶、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式_________________。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后得混合溶液VmL,将其分成4等份,加入淀粉溶液作指示剂,用0.0010mol·L-1的Na2S2O3溶液进行滴定,相关数据记录如下表所示:
| 编号 |
1 |
2 |
3 |
4 |
| 消耗Na2S2O3标准溶液的体积/mL |
18.02 |
17.98 |
18.00 |
20.03 |
部分反应离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;②I2+2S2O32-=2I-+S4O64-。
则判断达到滴定终点的现象是__________________。
废水中Ba2+的物质的量浓度为__________________。
高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为:
已知: Ⅰ.SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
| 沉淀完全的pH |
3.7 |
9.7 |
(1)操作①加快反应速率的措施有 (写一种)。
碳酸锶与盐酸反应的化学方程式 。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为 。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为 。
A.氨水 B.氢氧化锶粉末 C.氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是 (填化学式)。
(5)步骤④的操作是 、 、过滤。
(6)工业上用热风吹干六水氯化锶但不能脱结晶水,适宜的温度是 。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上