(原创)海洋中含有丰富的宝贵资源,除了制备粗盐,还可以提取碘,冶炼金属镁等。
I.海藻中含有丰富的碘元素,碘元素以I﹣的形式存在,Cl2可以将I﹣氧化得到碘单质,实验室从海藻中提取碘单质的实验流程如下:

(1)请写出相关操作的名称:①_____________________;③_______________________
(2)如果要求有色层在上层,可以选择_______________试剂进行碘单质的萃取(填字母)
| A.醋酸 | B.苯 | C.四氯化碳 | D.汽油 |
(3)实验中的“后期处理”主要是指分液和蒸馏,蒸馏采用实验装置如下图所示
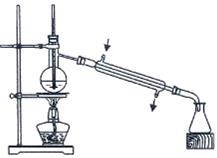
此图中的错误共有_________处(填数字)
II.海水经淡化可获得淡水和浓海水,浓海水中主要含有离子Na+、Mg2+、Cl﹣、SO42﹣。从浓海水中提取金属镁的一般工艺流程如下:
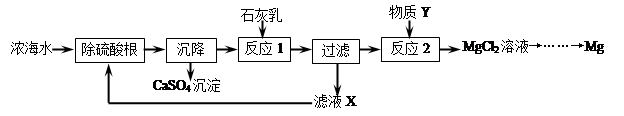
(1)补全由贝壳(主要成分为碳酸钙)生产石灰乳的相应转化中所需的条件或反应物:
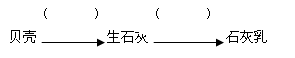
(2)写出反应2的化学方程式: 。
(3)操作流程中可循环使用的滤液X中的物质是 (填化学式)。
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将①50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题: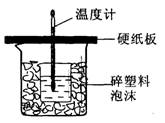
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________,烧杯间填满碎塑料泡沫的作用是_________________________________。
(2) 若将盐酸换成同浓度和同体积的醋酸,则求得的中和热数值_________(填“偏大”、“偏小’、“无影响”)
(3) 实验中改用40 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上
述实验相比,所放出的热量________(填“比①大”、 “比①小”或“相等”),理由是_____________________________;所求中和热的数值会________(填“相等”或“不相等”),理由是_____________________________。
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用下图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。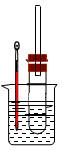
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL 溴乙烷,振荡。
实验操作II:将试管如图固定后,水浴加热。
(1)用水浴加热而不直接用酒精灯加热的原因是_______________________。
(2)观察到__________________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)鉴定生成物中乙醇的结构,可用的波谱是____________。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是______________________,检验的方法是
(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
某课外兴趣小组探究铝与盐酸反应的反应速率与哪些因素有关。请填写下列空白:
(1)实验化学反应原理:。
(2)实验用品:试管(普通试管和具支试管各一支)、镊子、乳胶管、玻璃导管、水槽、;稀盐酸(4mol/L)、铝条(片)、水、胶头滴管、温度计。
(3)实验装置(图中铁架台等夹持仪器略去)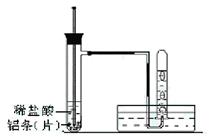
(4)实验方法
①按如图所示连接好实验仪器,检查装置的气密性
②取3块铝条(足量)加入到试管中。
③在盛有铝条的试管中,加入2mL稀盐酸。
④测量试管中溶液的温度。
⑤收集反应产生的氢气。
(5)数据处理及问题讨论
①实验结束后,课外兴趣小组成员将产生氢气的体积与时间作了如下的图。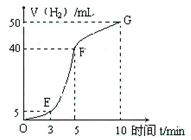
②试判断OE、EF、FG段所收集气体的多少。
OE:;EF:;FG:。
写出这三段时间内产生氢气的速率大小比较(用OE、EF、FG 表示),并解释原因。
速率大小比较:。原因:________
③如果反应太激烈,为了减缓反应速率而又不减少产生氢气
的量,他在盐酸中分别加入下列溶液:
| A.蒸馏水 | B.NaCl溶液 | C.Na2CO3溶液 | D.CuSO4溶液 E. NaNO3溶液 |
你认为可行的是(填编号)。
某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。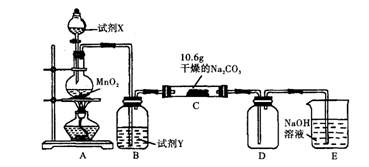
(1)写出装置A中发生反应的化学方程式:。
(2)写出试剂Y的名称:。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和;
假设2:存在三种成分:NaHCO3和、。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。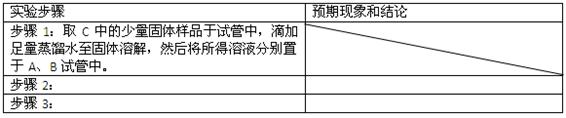
(4)已知C中有0.1mol Cl2参加反应。若假设l成立,可推知C中反应的化学方程式为 。
。
某中学化学课外活动小组欲探究铁在氯气中燃烧产物的成份、性质和用途,设计了如下实验步骤:
Ⅰ、用下列实验装置制取纯净干燥的氯气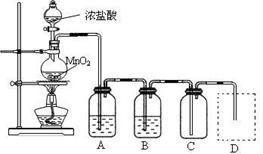
写出A、B中所盛放最佳化学试剂的名称、,画出虚线框内所需装置图并标明所需试剂的名称。
Ⅱ、某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分。探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②:;假设③:。
(2)设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空。
| 实验方法 |
实验现象 |
结论 |
| 在溶液中加 KSCN溶液 |
固体物质中有FeCl3 |
|
| 向a溶液中滴加 酸性KMnO4溶液 |
KMnO4溶液紫色 不褪色 |
固体物质中不含______ |
由此得出结论:假设成立(填序号①②③)。
Ⅲ、为进一步探究物质a的性质,他们又利用a溶液做了如下一些实验,其中现象、结论均正确的是_____________(填写序号)
A.向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,证明Ksp[Fe(OH)3]< Ksp[Mg(OH)2]
B.向a溶液中加入少量铁粉,铁粉溶解,溶液颜色由浅绿色变成黄色
C.向沸水中滴加a的饱和溶液,立即出现红褐色沉淀
D.将a溶液加热蒸干并灼烧,得到Fe2O3固体
IV、a溶液常作印刷电路铜板的腐蚀剂,写出发生反应的离子方程式。活动小组的同学们又设计了两种从上述废液中回收Cu的方案:
方案1:设计流程图如下: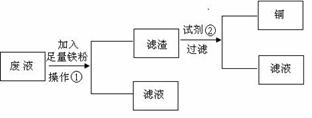
请分别写出操作①和试剂②的名称_________,_______。
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解,铜作________极。当观察到阴极有少量气泡产生时,停止电解,这时要回收的Cu已全部析出。
评价:方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:。