阅读下表中的相关信息。除N外,其余都是主族元素。
| 元素代号 |
相关信息 |
| T |
T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X |
X的原子2p轨道未成对电子数和成对电子数相等 |
| Y |
在第三周期元素中,Y的简单离子半径最小 |
| Z |
T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
| M |
M的氧化物是制造光导纤维的重要原料 |
| N |
位于第四周期,是人类最早使用的金属之一,单质呈红色 |
请按要求回答:
(1)元素T与X按原子个数比1∶1形成的化合物中所含的化学键类型有
,元素M与X形成的化合物B属于 晶体(填写晶体类型)。
(2)写出N基态原子电子排布式: 。
(3)元素T、Y、Z对应的单质的熔点高低顺序: > > (填化学式)。
(4)元素X、Y形成的简单离子半径大小: > (填相应的离子)。
(5)向Y与Z形成的化合物的水溶液中,加入过量T的最高价氧化物对应水化物的溶液,写出该反应的离子方程式: 。
(6) 一定条件下,X、Y两种单质以及有孔惰性电极在化合物TZ的水溶液中可形成原电池,为新型海水航标灯提供能源,该电池正极电极反应是: 。
PBS是一种可降解的聚酯类高分子材料,可由马来酸酐等原料经下列路线合成: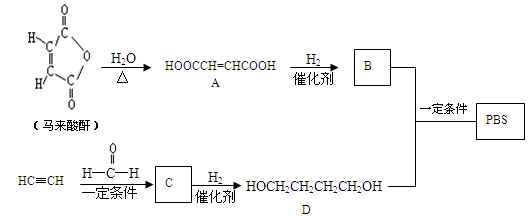
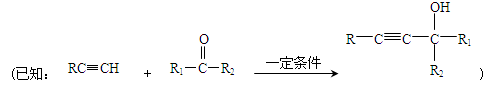
(1)A→B的反应类型是 ;B的结构简式是 。
(2)C中含有的官能团名称是 ;D的名称(系统命名)是 。
(3)半方酸是马来酸酐的同分异构体,分子中含1个环(四元碳环)和1个羟基,但不含—O—O—键。半方酸的结构简式是 。
(4)由D和B合成PBS的化学方程式是 。
(5)下列关于A的说法正确的是 。
a.能使酸性KMnO4溶液或溴的CCl4溶液褪色
b.能与Na2CO3反应,但不与HBr反应
c.能与新制Cu(OH)2反应
d.1molA完全燃烧消耗5molO2
化合物A(C11H8O4)在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C。回答下列问题:
B的分子式为C2H4O2,分子中只有一个官能团。则B的结构简式是________,B与乙醇在浓硫酸催化下加热反应生成D,该反应的化学方程式是________________________,该反应的类型是________;写出两种能发生银镜反应的B的同分异构体的结构简式________________________。
C是芳香化合物,相对分子质量为180,其碳的质量分数为60.0%,氢的质量分数为4.4%,其余为氧,则C的分子式是________。
(3)已知C的芳环上有三个取代基,其中一个取代基无支链,且还有能使溴的四氯化碳溶液退色的官能团及能与碳酸氢钠溶液反应放出气体的官能团,则该取代基上的官能团名称是 。另外两个取代基相同,分别位于该取代基的邻位和对位,则C的结构简式是 。
(4)A的结构简式是 。
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,在将滤液按下图所示步骤进行操作。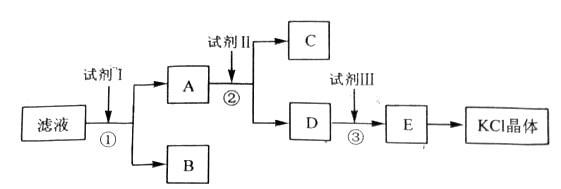
回答下列问题:
起始滤液的pH_____________7(填“大于”、“小于”或“等于”),其原因是_________________________________________________。
试剂I的化学式为______________________,①中发生反应的离子方程式为____________________________________________。
试剂Ⅱ的化学式为______________________,②中加入试剂Ⅱ的目的是__________________________________________________________________;
试剂Ⅲ的名称是______________________,③中发生反应的离子方程式为__________________________________________________________________;
某同学称取提纯的产品0.7759g,溶解后定定容在100mL容量瓶中,每次取25.00mL溶液,用0.1000mol·L-1的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.62mL,该产品的纯度为____________________________________________。(列式并计算结果)
已知:—CHO + (C6H5)3P="CH—R" → —CH="CH—R" + (C6H5)3P=O,R代表原子或原子团。W是一种有机合成中间体,结构简式为:HOOC—CH=CH—CH=CH—COOH,其合成发生如下: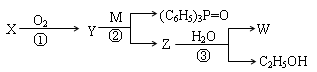
其中,M、X、Y、Z分别代表一种有机物,合成过程中的其他产物和反应条件已略去。X与W在一定条件下反应可以生成酯N,N的相对分子质量为168。
请回答下列问题:
(1)W能发生反应的类型有 (填写字母编号)
| A.取代反应 | B.水解反应 | C.氧化反应 | D.加成反应 |
(2)已知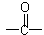 为平面结构,则W分子中最多有 个原子在同一平面。
为平面结构,则W分子中最多有 个原子在同一平面。
(3)写出X与W在一定条件下反应生成N的化学方程式 。
(4)写出含有3个碳原子且不含甲基的X的同系物的结构简式: 。
(5)写出第②步反应的化学方程式 。
已知:
为合成某种液晶材料的中间体M,有人提出如下不同的合成途径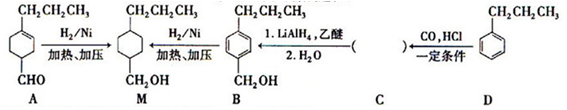
(1)常温下,下列物质能与A发生反应的有_______(填序号)
a.苯 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+溶液
(2)M中官能团的名称是____,由C→B反应类型为________。
(3)由A催化加氢生成M的过程中,可能有中间生成物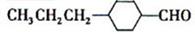 和______(写结构简式)生成
和______(写结构简式)生成
(4)检验B中是否含有C可选用的试剂是_____(任写一种名称)。
(5)物质B也可由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式为______。
(6)C的一种同分异构体E具有如下特点:
a.分子中含—OCH3CH3 b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式__________________。