(11)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题: 
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③列式计算电极b上生成的气体在标准状态下的体积: ;
④电极c的质量变化是 g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ; 乙溶液 ; 丙溶液 ;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? 。
水在自然界净化中要把有机污物自发地转变为简单的无机物质时,需要水中含有一定的氧气〔有机物(C、H、O)+O2→CO2+H2O〕,1 L水中含有的有机物转变为无机物所需要的氧的量称为生化需氧量(BOD),用g·L-1为单位表示,如果水的氧气量比BOD少,水就发臭,鱼和其他淡水生物就不会生存。某地区一条河水里有机物的质量分数为0.01%,此有机物的化学式可用C6H10O5表示,已知在正常大气压条件下,氧气在水中的溶解量是0.092 g·L-1。
(1)写出有机物在有氧气条件下转化为无机物的化学方程式_________________________。
(2)这条河水的生化需氧量为___________________________________________________。
(3)这条河中的鱼类____________(填“能”或“不能”)维持生命。
当铁丝加热后放入氧气中可观察到___________现象。说明这个反应是___________反应(填“吸热”或“放热”),说明铁单质的稳定性___________(填“强”或“弱”)。
已知:H2(g)+ 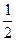 O 2(g)====H2O(g),反应过程中能量变化如下图,问:
O 2(g)====H2O(g),反应过程中能量变化如下图,问:
(1)a、b、c分别代表什么意义?
a._____________________________________________________________________________;
b._____________________________________________________________________________;
c.
_____________________________________________________________________________。
(2)该反应是放热还是吸热?___________。ΔH大于零还是小于零?___________。
科学家预言未来最理想的燃料是绿色植物,即将植物的秸秆[主要成分是纤维素,化学式为(C6H10O5)n],用适当催化剂与水作用生成葡萄糖(分子式为C6H12O6),再在催化剂作用下使葡萄糖分解成乙醇和二氧化碳,乙醇即是一种理想的燃料。试写出两步转化的化学方程式:______________________________、
___________________________________。
(7分)现有下列高聚物:
A.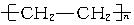 |
B.天然橡胶 | C.硫化橡胶 | D.用于制备电木的酚醛树脂 (E)有机玻璃,其中属于线型结构的是___________,属于体型结构的是___________,可溶于有机溶剂的是___________,加热能熔融的是___________,用于制备轮胎的是___________,用于制备车窗玻璃的是___________,用于制备插座、电器把手的是______________________。 |