用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 |
| B.标准状况下,1.12 L的HCHO所含的原子数是0.2NA |
| C.1 L0.5mol/LNa2CO3溶液中含有的CO32-数目为0.5NA |
| D.16.9 g过氧化钡(BaO2)固体中阴、阳离子总数为0.3NA |
下列离子方程式正确的是
| A.向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH+Al3++2SO+2Ba2++5OH-=AlO+2BaSO4↓+NH3·H2O+2H2O |
| B.工业上用石灰乳制备漂白粉:Ca(OH)2+Cl2=Ca2++ClO-+Cl-+ H2O |
C.制备Fe(OH)3胶体: Fe3++3H2O  Fe(OH)3(胶体)+3H+ Fe(OH)3(胶体)+3H+ |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: |
2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
据最新报道,科学家发现了如下反应:O2+PtF6=O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt的化合价为+5,对于此反应,下列说法正确的是
| A.O2是氧化剂,PtF6是还原剂 |
| B.O2(PtF6)中氧元素的化合价为+1 |
| C.O2(PtF 6)中不存在共价键 |
| D.每生成1mol O2(PtF6)则转移1mol电子 |
标准状况下,将体积为V L的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg·cm-3。下列说法错误的是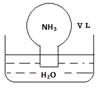
| A.水最终会充满整个烧瓶 |
| B.所得溶液的物质的量浓度为1/22.4 mol·L-1 |
| C.所得溶液的质量分数为17/22400ρ |
| D.所得溶液中,n(NH3·H2O)+n(NH4+)="V/22.4" mol |
有下列两种转化途径,某些反应条件和产物已省略,下列有关说法不正确的是
途径①: 途径②:
途径②: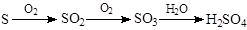
| A.途径①反应中体现了浓硝酸的强氧化性和酸性 |
| B.途径②的第二步反应在实际生产中可以通过增大O2浓度来提高产率 |
| C.由途径①和②分别制取1mol H2SO4,理论上各消耗1mol S,各转移6mol电子 |
| D.途径②与途径①相比更能体现“绿色化学”理念,是因为途径②比途径①污染相对小且原子利用率高 |
某气体的摩尔质量为M g·mol-1,NA表示阿伏加德罗常数,在一定的温度和压强下,体积为V L的该气体所含有的分子数为x。则 表示的是
表示的是
| A.V L该气体的质量(以g为单位) | B.1 L该气体的质量(以g为单位) |
| C.1 mol该气体的体积(以L为单位) | D.1 L该气体中所含的分子数 |