下列叙述正确的是( )
| A.1 mol H2O的质量为18g/mol | B.CH4的摩尔质量为16g |
| C.3.01×1023个SO2分子的质量为32g | D.标准状况下,1 mol任何物质体积均为22.4L |
下列做法中用到物质氧化性的是
| A.臭氧消毒餐具 | B.纯碱除去油污 |
C.食醋清洗水垢 |
D.明矾净化水 |
下列有关物质的分类或归类正确的是
①混合物:石炭酸、福尔马林、水玻璃、水银
②化合物:CaCl2 、烧碱、聚苯乙烯、HD
、烧碱、聚苯乙烯、HD
③电解质:明矾、胆矾、冰醋酸、硫酸钡
④同素异形体:C60、C70、金刚石、石墨
| A.①③ | B.②③ | C.②④ | D.③④ |
分类法在化学的发展中起到了重要作用,下列有关分类标准的叙述合理的是
| A.根据氧化物的组成将氧化物分为酸性氧化物、碱性氧化物和两性氧化物 |
| B.根据化学反应中的热效应将化学反应分为放热反应和吸热反应 |
| C.根据水溶液能否导电将化合物分为电解质和非电解质 |
| D.根据分散质和分散剂的聚集状态将分散系为浊液、胶体和溶液 |
(12分)某固体混合物可能含Al、(NH4)2SO4、MgCl2、A1Cl3、FeCl2、NaCl中的一种或几种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标况下体积):
回答下列问题: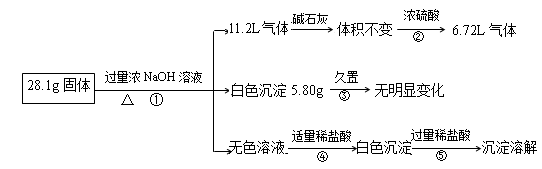
(1)混合物中是否存在FeCl2___(填“是”或“否”);你的判断依据是:
.
(2)混合物中是否存在(NH4)2SO4___(填“是”或“否”),你的判断依据是:
。
(3)写出反应④的离子反应式:。
(4)请根据计算结果判断混合物中是否含有AlCl3___(填“是”或“否”),你的判断依据是:
。
将x mol O2、y mol CH4、z mol Na2O2投入密闭容器内,在150℃条件下,电火花引发反应后,反应物均无剩余, 容器内压强为零,则下列x、y、z之间的关系式中正确的是( )
| A.Z=" 3X" + 2Y | B.4Y =" 2X" + Z | C.3X ="Y" + 5Z | D.6Y=" 2X" + Z |