根据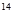 C含量,能测出古代物品所处的年代。
C含量,能测出古代物品所处的年代。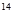 C中的“14”是指碳原子中的
C中的“14”是指碳原子中的
| A.质子数 | B.中子数 | C.电子数 | D.质量数 |
下列说法正确的是( )
| A.pH=7的溶液一定显中性 |
| B.pH=6的溶液一定显酸性 |
| C.c(H+)<c(OH-)的溶液一定显碱性 |
| D.c(OH-)=1×10-6 mol/L的溶液一定显酸性 |
X、Y为两种元素的原子,X的阴离子与Y的阳离子具有相同的电子层结构,由此可知( )
| A.X的原子半径大于Y的原子半径 |
| B.X的电负性大于Y的电负性 |
| C.X阴离子的半径小于Y阳离子的半径 |
| D.X的第一电离能小于Y的第一电离能 |
在基态多电子原子中,关于核外电子能量的叙述错误的是( )
| A.最易失去的电子能量最高 |
| B.电离能最小的电子能量最高 |
| C.p轨道电子能量一定高于s轨道电子能量 |
| D.在离核最近区域内运动的电子能量最低 |
下列关于热化学反应的描述中正确的是()
A.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g) 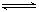 2NH3(g) △H=-38.6kJ·mol-1 2NH3(g) △H=-38.6kJ·mol-1 |
| B.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1 |
| C.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ·mol-1 |
| D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
含11.2g KOH的稀溶液与1L、0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列能正确表示中和热的热化学方程式是()
| A.KOH(aq) + 1/2 H2SO4(aq) = 1/2K2SO4(aq) + H2O(l);ΔH =-11.46kJ/mol |
| B.2KOH(s) + H2SO4(aq) = K2SO4(aq) + 2H2O(l);ΔH =-114.6kJ/mol |
| C.2KOH(aq) + H2SO4 =K2SO4(aq) + H2O(l);ΔH =+114.6kJ/mol |
| D.KOH (aq) + 1/2 H2SO4(aq) = 1/2K2SO4(aq) + H2O(l);ΔH =-57.3kJ/mol |