下列表示对应化学反应的离子方程式正确的是
| A.铜与硝酸银溶液反应:Cu + Ag+ = Cu2++ Ag |
B.氯气溶于水:Cl2 + H2O H++ Cl-+ HClO H++ Cl-+ HClO |
| C.硫酸溶液中滴加氢氧化钡溶液:H++ SO42-+ Ba2++ OH-= H2O + BaSO4↓ |
| D.氯化钙溶液中通入二氧化碳气体:Ca2++CO2+H2O=CaCO3↓+2H+ |
实验是化学研究的基础,关于下列各实验装置图的叙述中,最合理的是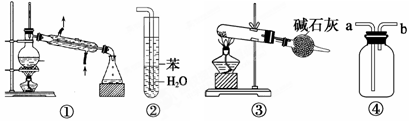
| A.装置①常用于分离互不相溶的液体混合物 |
| B.装置②可用于吸收氨气,能够防止倒吸 |
| C.以NH4Cl为原料,装置③可用于制备少量NH3 |
| D.装置④ a口进气可收集Cl2、NO2等气体 |
下列有关实验操作的说法正确的是
| A.可用25 mL碱式滴定管量取20.00 mL KMnO4溶液 |
| B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 |
| C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干 |
| D.为了使过滤速率加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 |
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
| W |
X |
|
| Y |
Z |
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性强于Y
D.Z元素单质在化学反应中只表现氧化性
海带中碘元素的分离实验中,在灼烧后的海带灰中加入蒸馏水,煮沸2~3 min,再过滤,得到滤液。煮沸的目的是
| A.加快碘元素与水反应的速率 | B.使溶液浓缩 |
| C.使空气中的氧气更多地进入溶液 | D.加速碘化物的溶解 |
下图中每条折线表示周期表ⅥA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
| A.H2S | B.HCl | C.PH3 | D.SiH4 |