25℃时,如果取0.5mol/LHA溶液与0.5mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得pH=10。试回答以下问题:
(1)混合溶液中由水电离出的c(H+)_______0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(2)用方程式解释为什么混合后溶液的pH﹥7
(3)求出混合溶液中下列算式的计算结果(填具体数字):
c(A-)+c(HA)= mol/L; c(OH-)-c(HA)= mol/L。
短周期元素的单质X、Y、Z在通常状况下均为气态,并有右图转化关系(反应条件略去),已知: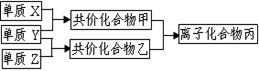
a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是_______________________。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。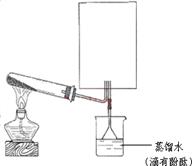
①在图中方框内绘出收集甲的仪器装置简图。
②试管中的试剂是____________________。(填写化学式)
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)_________________________。 (3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是__________。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是__________。
某高分子材料的结构如右图,则其对应的单体的结构简式为:______________________,______________________。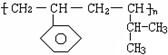
组成一种原电池如图所示。试回答下列问题(灯泡功率合适):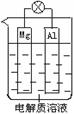
(1)电解质溶液为稀H2SO4时,灯泡______(填“亮”做①题,填“不亮”做②题) 。
。
①若灯泡亮,则Mg电极上发生的反应为:____________________;
Al电极上发生的反应为:___________________________________。
②若灯泡不亮,其理由为:__________________________________。
(2)电解质溶液为NaOH溶液时,灯泡_____(填“亮”做①题,填“不亮”做②题)。
①若灯泡亮,则Al电极上发生的反应为:_____________________________。
②若灯泡不亮,其理由为:__________________________________________。
已知A是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。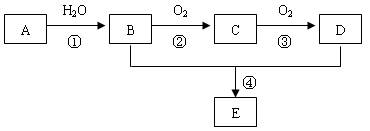
请回答下列问题:
(1)写出A的结构简式。
(2)B、D分子中的官能团名称分别是、。
(3)物质B可以被直接氧化为D,需要加入的试剂是。
(4)写出下列反应的化学方程式:
①;反应类型:。
④。反应类型:。
某烷烃的蒸气质量是相同条件下氢气质量的36倍,该烃的分子式为____________,写出该烃同分异构体的结构简式: