(5分)下表是关于有机物A、B的信息:
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称为 ;
写出在一定条件下,A发生聚合反应生成高分子的化学方程式 。
(2)A的同系物用通式CnHm表示,B的同系物用通式CxHy表示,当CnHm、CxHy分别出现同分异构体时,碳原子数的最小值n = , x = 。
(3)B具有的性质是
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤能使酸性KMnO4溶液和溴水褪色⑥任何条件下均不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色
目前正在研究和已经使用的储氢合金有镁系合金、稀土系合金等。
(1)已知:Mg(s)+H2(g)=MgH2(s)△H1=-74.5 kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2 =-64.4 kJ·mol-1
Mg2Ni(s)+2MgH2(s)=2Mg(s)+ Mg2NiH4(s) △H3,则△H3 = kJ·mol-1。
(2)工业上用电解熔融的无水氯化镁获得镁。其中氯化镁晶体脱水是关键工艺之一,一种氯化镁晶体脱水的方法是:先将MgCl2·6H2O转化为MgCl2·NH4C1·nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 。
(3)储氢材料Mg(AlH4)2在110~200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑。生成2.7gAl时,产生的H2在标准状况下的体积为 L。
(4)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①下图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由下图可知,下列说法正确的是 (填字母)。
a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②下图为25℃和75℃时,Al-LiBH4复合材料[w (LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。
从图中可知,25℃时Al-LiBH4复合材料中与水完全反应的物质是 (填化学式)。
(5)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
①某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K= 。
②一定条件下,下图装置可实现有机物的电化学储氢(忽略其它有机物)。生成目标产物的电极反应式为 。
工业上用NH3和CO2反应合成尿素:
2NH3(g)+ CO2(g) CO(NH2)2(g)+ H2O(g)△H1=-536.1 kJ·mol-1
CO(NH2)2(g)+ H2O(g)△H1=-536.1 kJ·mol-1
(1)此反应的平衡常数表达式K= 。升高温度,K值 (填增大、减小或不变)。
(2)其他条件不变,下列方法能同时提高化学反应速率和尿素产率的是 。
| A.通入氦气 | B.缩小体积 |
| C.加入催化剂 | D.除去体系中的水蒸气 |
(3)尿素可用于处理汽车尾气。CO(NH2)2(g)与尾气中NO反应生成CO2、N2、H2O(g)排出。又知:4NH3(g)+ 6NO(g)=5N2(g)+ 6H2O(g) △H2=-1806.4 kJ·mol-1,写出CO(NH2)2(g)与NO反应的热化学方程式 。
某小组模拟工业合成尿素,探究起始反应物的氨碳比[n(NH3)/n(CO2)]对尿素合成的影响。在恒温下1L容器中,将总物质的量为3mol的NH3和CO2以不同的氨碳比进行反应,实验测得平衡体系中各组分的变化如图所示。回答问题: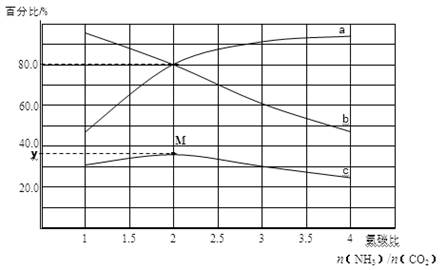
(4)若a、b线分别表示NH3或CO2转化率的变化,其中表示NH3转化率的是 (填a或b)线。
(5)若a、b线分别表示NH3或CO2转化率的变化,c线表示平衡体系中尿素体积分数的变化,求M点对应的y值(写出计算过程,结果精确到0.1)。
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下: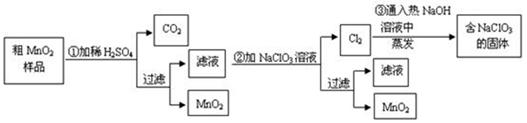
(1)在第①步反应中,为加快反应速率,可采取的措施有 (任写一种),产生CO2气体的的方程式是 ;
(2)写出步骤②中所发生的离子方程式 ;
(3)如果蒸发得到的固体中,只含NaClO3和NaCl,为得到比较纯的NaClO3溶液,结合下面各物质的溶解度与温度的关系,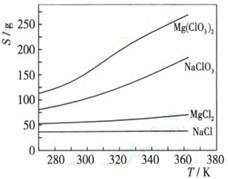 。
。
其基本操作是:将固体溶于适量水,通过 , ,便可得到较纯的NaClO3溶液。
(4)工业上也常用石墨做电极,电解酸化的MnSO4溶液来制MnO2,则阳极上所发生的离子方程式 。
(1)乙醇是重要的有机化工原料,可由乙烯直接水合法生产。
已知:甲醇脱水反应①2CH3OH(g) = CH3OCH3(g)+H2O(g)△H1=-23.9KJ·mol-1
甲醇制烯烃反应②2CH3OH(g) = C2H4 (g)+2H2O(g)△H2=-29.1KJ·mol-1
乙醇异构化反应③CH3CH2OH(g) = CH3OCH3(g))△H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g) C2H5OH(g) △H= ;
C2H5OH(g) △H= ;
(2)乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图。结合曲线归纳平衡转化率-T曲线变化规律:
(a) ;
(b) ;
(3)若要进一步提高乙烯的转化率,可以采取的措施有 。
A.增大乙烯的浓度
B.分离出乙醇
C.加催化剂
(4)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时FeO(s)转化率为50%,求x的值。(写出计算步骤)
【改编】单体液晶(有机物III)是用偶联反应合成的:
反应①
反应②
试回答以下问题:
(1)有机物Ⅲ中官能团的名称为 :有机物Ⅰ能发生的反应为 :
①加成反应②酯化反应③醇氧化为醛(或酮) ④消去反应
(2)若要通过反应②制备 ,则需要两种有机物的结构简式分别是 。
,则需要两种有机物的结构简式分别是 。
(3)写出由有机物III制备  的反应方程式 。
的反应方程式 。
(4)符合下列条件的有机物III同分异构体有 种。
①苯环上有2个取代基;
②能发生银镜反应;
③分子中含有2个甲基。
(5)CH≡CCH2OH与CH3I能发生类似①的反应,该反应方程式是: 。