已知:2NO2(g) N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图⑴所示。请回答:
N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图⑴所示。请回答: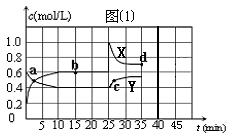
(1)a点时,v(正) v(逆)(填“<”、“>”或“=”),X线、Y线中代表N2O4的是 ;
(2)反应在第10 min达到平衡,则前10 min内用NO2表示的化学反应速率v(NO2)= mol·L-1·min-1。该温度下,反应的平衡常数K= (可用分数表示);
(3)在第25分钟,进行的操作是 ;
(4)a、b、c、d四点对应的时刻,NO2物质的量浓度由小到大的顺序是 ,再次平衡时的d点NO2的体积分数比b点时 (填“大”、“小”或“相等”);
(5)假如在第35分钟从容器中移去0.4mol N2O4,并加入适当催化剂使反应在第40分钟达到平衡,请在图⑴中画出从第35分钟以后两种物质的物质的量浓度c随时间t的变化关系,并标注所画线条对应的物质。
(13分) 现有常温时浓度相同的五种电解质溶液:
①CH3COOH②Na2CO ③HNO3④CH
③HNO3④CH COONa⑤NaOH
COONa⑤NaOH
(1)五种溶质中是弱电解质的是______(填编号),若常温时该弱电解质电离常数为K,1mol/L的该溶液中c(H+)约为__________mol/L(用K表示)
(2)④溶液中离子与分子共______种(包括水分子)。
(3)这五种溶液的pH由小到大的顺序是______________________________(填编号)。
(4)将 CH COONa溶液稀释100倍时,其pH变化如图中_______曲线(填字母).
COONa溶液稀释100倍时,其pH变化如图中_______曲线(填字母).
(5)上 述五种溶液中分别加入AlCl3溶液,有气泡产生的是(填编号),写出能产生气泡现象的离子方程式: .
述五种溶液中分别加入AlCl3溶液,有气泡产生的是(填编号),写出能产生气泡现象的离子方程式: .
(12分) 某一反应体系中,有反应物和生成物共六种物质,这六种物质是:Cl2、KMnO4、MnCl2、H2O、HCl(浓)、KCl,其中KMnO4 → MnCl2。
(1)该反应中的化学方程式为_____________________________________________。
(2)该反应中,氧化产物与还原产物的物质的量之比为_____________________________。
(3)若产生的气体在标准状况下体积为2.24 L,则反应过程中被氧化的物质为________ NA(NA表示阿伏伽德罗常数的值)。
(4)市售的浓盐酸(密度为1.19g/cm3)在工业上是用500 L HCl气体(标准状况)与1 L H2O的比例配制成的,则该盐酸的物质的量浓度是___________mol/L(结果保留一位小数)。
(5)现需用1.20 mol/L的稀盐酸480  mL, 应量取市售浓盐酸________mL进行配制。
mL, 应量取市售浓盐酸________mL进行配制。
(5)取6.00 g硬铝合金(假设只含铝铜硅),与 (5) 中所配稀盐酸进行充分反应,收集到气体5.60 L(标准状况),则硬铝合金中铝的质量分数为____________。
(10分) 对一份稀溶液作初步分析后发现,溶液无色、澄清,其可能含有 HCO3-、Cl-等离子中的若干种。然后又作了如下的实验分析:
HCO3-、Cl-等离子中的若干种。然后又作了如下的实验分析:
①用石蕊试液检测该溶液时,溶液显红色。
②用铂丝蘸取溶液在无色火焰上灼烧,透过蓝色的钴玻璃片观察火焰呈紫色。
③取2 mL溶液用BaCl2溶液和稀硝酸进行检验,结果生成了白色沉淀。
④对③中所得的混合物充分静置后,取其上层澄清的液体用AgNO3溶液和稀硝酸进行检验,结果又生成了白色沉淀。
请回答下列问题:
(1)原溶液中一定存在的离子是_________________,一定不存在的离子是 ____________。
____________。
(2)通过上述实验操作,不能肯定在原溶液中是否存在的离子是____________________。
(3)在上述实验操作中,有错误的步骤是(填步骤序号)________。对该错误改正的方法是(作出简答)______________________________________________________________。
(13分) 下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
(已知:2Al + 3FeO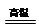 3Fe + Al2O3;2
3Fe + Al2O3;2 Al + Fe2O3
Al + Fe2O3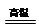 2Fe + Al2O3;
2Fe + Al2O3;
8Al + 3Fe3O4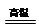 9Fe + 4Al2O3)
9Fe + 4Al2O3)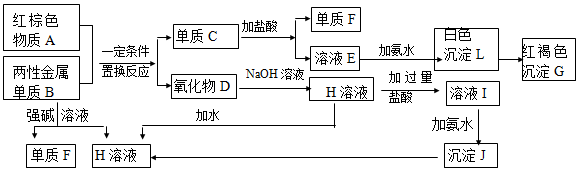
(1)化合物A的化学式是,写出物质A的一种用途。
(2)写出单质B与强碱溶液反应的离子方程式。
(3)写出由沉淀J生成 H溶液的离子方程式 。
。
(4)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式。
白色沉淀L会迅速变为 色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式。
色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式。
(5)溶液I中所含金属离子是_____________________。
(17分) 现有下列十种物质:
①H2②铝③CaO④CO2⑤H2SO4⑥Ba(OH)2
⑦红褐色的氢氧化铁液体⑧氨水⑨稀硝酸⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 |
金属单质 |
氧化物 |
溶液 |
胶体 |
电解质 |
| 属于该类的物质 |
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-= H2O,该离子反应对应的化学方程 式为__________________________________________________________。
式为__________________________________________________________。
(3)⑩在水中的电离方程式为__________________________________________________,
(4)少量的④通入⑥的溶液中反应的离子方程式为________________________________。
(5)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,该反应的氧化剂是____________(填化学式),氧化剂与还原剂的物质的量之比是_____________,当有5.4g Al发生反应时,转移电子的物质的量为_________________。该反应的离子方程式为___________________________________________________。