(12分)一定温度下,向如图所示带有可移动活塞的密闭容器中充入2 L SO2和1 L O2的混合 气体,发生如
气体,发生如 下反应2 SO2 (g) + O2 (g)
下反应2 SO2 (g) + O2 (g) 
 2 SO3 (g
2 SO3 (g ) 。
) 。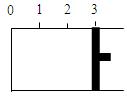
(1) 若活塞可自由移动,平衡后,活塞停止在“2.1”处该反应中SO2的转化率为 。
(2) 若开始时,充入容器的起始物质分别是
①2 L SO2和1 L O2;
②2 L SO3 (g) 和 1 L N2 ;
③1 L SO2、1 L O2和 1 L SO3 (g),
使活塞固定在“3”处,达到平衡后,容器中SO3 (g)占反应混合物的体积分数的大小关系是: (用序号①②③和“<”、“=”、“>”表示)。
(3) 向(1)平衡后的容器中充入0.2 mol 的SO3,活塞移动后再次达到平衡时,测得此过程中从外界共吸收了1.96 kJ 的热量。写出SO2发生氧化反应的热化学方程式:  _______________。
_______________。
常温下,某未知酸性溶液中,可能含有大量的Cl-、OH-、CO32-、H+、Ag+、Fe3+ 等离子。你认为其中一定含有的离子是,一定不含有的离子是,还需进一步检验的离子是,为了进一步确认是否含该离子,需要的试剂和现象为。
1mol Na2SO4的质量为克,含有个氧原子,其水溶液的电离方程式为。
铝是一种重要金属:(1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:
(2)工业上用铝土矿(主要成分为A12O3,还有少量的Fe2O3 ,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下: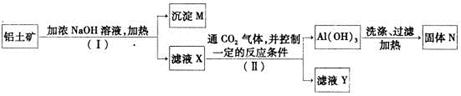
①I和II步骤中分离溶液和沉淀的操作是;;
②沉淀M中除含有泥沙外,一定还含有,固体N是;
③滤液X中,含铝元素的溶质的化学式为,它属于(填“酸”、“碱”或“盐”)类物质;
④实验室里常往AlCl3溶液中加入(填“氨水”或“NaOH溶液”)来制取
A1(OH)3。其反应的离子方程式为:___________________________________________。
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e-=NO+2H2O ; KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:。
(2)反应中硝酸体现了、性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
(5)KMnO4在酸性溶液中发生还原反应的反应式:______。
为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。试填空。
(1)D装置中主要反应的离子方程式为,
F仪器的作用是:。
(2)为验证通入D装置中气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试剂:
a 氯化铁稀溶液 b 氯化亚铁溶液 c硫氰化钾溶液
d 苯酚溶液 e 品红溶液 f 酸性高锰酸钾溶液
①若Cl2过量:取适量D中溶液滴加至盛有(选填一个符号)试剂的试管内,再加入_(选填一个符号)试剂,发生的现象是:;
②若选用上述试剂中的一种结合必要的操作就可以验证通入C装置中气体是Cl2过量还是SO2过量,该试剂是_________。(选填一个符号)
必要操作和结论______________________________________。