用98﹪、密度为1.84 g/cm3的H2SO4溶液配制100mL、4.0mol/L H2SO4溶液。试回答:
(1)实验时使用的仪器除烧杯、量筒外还需要 、 、 ;
(2)取用浓硫酸的体积是 mL;
(3)定容时不慎加水超过刻度线,你的正确做法 。
(8分)混合物平均摩尔质量通常可表示为: ,利用此概念可以讨论许多化学问题:
,利用此概念可以讨论许多化学问题:
(1)相同条件下,潮湿空气的密度(选填“>”、“<”或“=”)干燥空气的密度。
(2)在一定条件下的恒容密闭容器中,建立如下平衡:5O2(g)+4NH3(g)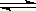 4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡(填“正向移动”、“逆向移动”、“不移动”),
4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡(填“正向移动”、“逆向移动”、“不移动”), (混合气)将(填写“变大”、“变小”或“不变”);
(混合气)将(填写“变大”、“变小”或“不变”);
(3)在一定温度下恒容密闭容器中,当下列物理量不再变化时,不能表明反应:A(s)+2B(g) C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是
| A.混合气体的平均相对分子质量 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.气体的总物质的量 |
一包粉末可能含有K+、Fe3+、Al3+、Cl-、SO42-、CO32-中的若干种,现进行以下实验:
(1)取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
(2)向(1)所得溶液中加入一定量Ba(OH)2溶液,生成有色沉淀,过滤后在滤液中加入稀硝酸酸化,然后滴入AgNO3溶液,有白色沉淀生成;
(3)取(2)中的有色沉淀加入足量的稀盐酸后,沉淀全部溶解;
(4)重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
(5)向(4)所得的溶液中加入氨水使溶液呈碱性,有沉淀生成,过滤。往得到的沉淀中加入过量的NaOH溶液,沉淀减少。
根据上述实验,这包粉末中一定不含有的离子是,肯定含有的离子是,不能确定是否含有的离子是,可通过(填实验方法)来进一步确定该离子。
有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大。
①A元素最外层电子数是次外层电子数的2倍。
②B的阴离子和C的阳离子与氖原子的电子层结构相同。
③在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移。
④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质。
⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应。
请写出:
(1)A元素的最高价氧化物的电子式 。
(2)B元素在周期表中的位置 。
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有。
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为______________。
(5)C与D能形成2:1的化合物,用电子式表示该化合物的形成过程的。
(6)元素D与元素E相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是(填选项序号)。
a.常温下D的单质和E的单质状态不同
b.E的氢化物比D的氢化物稳定
c.一定条件下D和E的单质都能与钠反应
d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质
已知X和Y均是元素周期表中同一主族元素的单质,W、V是化合物,它们有如下反应:(式中各物质的化学计量数及反应条件均已略去)X+W→Y+V
试写出符合题意且满足下列要求的化学方程式
① W是H2O:②V的水溶液是酸:
③W、V都是氧化物:④V是水:
(10分)化合物甲、乙、丙有如下转化关系:
回答:
(1)甲中官能团的名称是________,甲属________类物质,甲可能的结构有________种,其中可催化氧化为醛的有________种.
(2)反应条件①为__________________________________________.
条件②为_______________________________________________.
(3)甲→乙的反应类型为________,乙→丙的反应类型为________.
(4)丙的结构简式不可能是________.
| A.CH3CH2CHBrCH2Br |
| B.CH3CH(CH2Br)2 |
| C.CH3CHBrCHBrCH3 |
| D.(CH3)2CBrCH2Br |