有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大。
①A元素最外层电子数是次外层电子数的2倍。
②B的阴离子和C的阳离子与氖原子的电子层结构相同。
③在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移。
④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质。
⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应。
请写出:
(1)A元素的最高价氧化物的电子式 。
(2)B元素在周期表中的位置 。
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有 。
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为______________。
(5)C与D能形成2:1的化合物,用电子式表示该化合物的形成过程的 。
(6)元素D与元素E相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填选项序号)。
a.常温下D的单质和E的单质状态不同
b.E的氢化物比D的氢化物稳定
c.一定条件下D和E的单质都能与钠反应
d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质
⑴探究物质的结构有助于对物质的性质进行研究。
① 下列物质中含有醇羟基的是(填字母)。
a.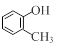 b.
b. c.
c.
② 下列物质分子中所有原子处于同一平面的是(填字母)。
a.溴苯 b.丙烯 c.甲醇
③ 欲区分HCHO和HCOOH,应选用(填字母)。
a.NaOH溶液 b.酸性KMnO4溶液 c.NaHCO3溶液
⑵有机化学中的同分异构现象十分普遍。
① C3H6O的一种有机物能与新制的氢氧化铜悬浊液反应,该有机物的结构简式为。
② 有机物C5H10O2属于羧酸类的同分异构体有种,其中一种的核磁共振氢谱图(1H核磁共振谱图)中显示两个峰,该有机物的结构简式为。
③环状化合物M(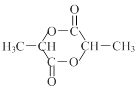 )由两分子某链状有机物A反应得到,则与链状有机物A互为同分异构体且含有相同官能团的结构简式为。
)由两分子某链状有机物A反应得到,则与链状有机物A互为同分异构体且含有相同官能团的结构简式为。
⑶科学家常采用将药物连接在高分子载体上,制成缓释长效药物。已知某种解热镇痛类药物的结构简式为A,把它连接到高分子聚合物B上,形成缓释长效药物C。
A: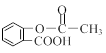 C :
C :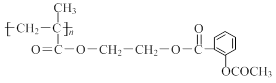
① HO-CH2-CH2-OH的名称为。
② 高分子聚合物B的单体的结构简式为。
③ A与B反应生成C的反应类型是。
④ 在酸性条件下,A可水解成CH3COOH和(填结构简式)。
请写出检验A是否已水解的实验方法和现象。
化合物H是重要的有机化合物,可由E和F在一定条件下合成:(有些反应条件省略如:加热等)
已知以下信息:
A属于芳香烃,H属于酯类化合物。
I的核磁共振氢谱为二组峰,且峰的面积比为6:1。
回答下列问题:
(1)B的结构简式,C的官能团名称。
(2)B C;G
C;G J两步的反应类型 ,。
J两步的反应类型 ,。
(3)①E+F H的化学方程式。
H的化学方程式。
②I G 的化学方程式。
G 的化学方程式。
(4)H的同系物K比H相对分子质量小28,K的同分异构体中能同时满足如下条件:
①属于芳香族化合物
②能和饱和NaHCO3溶液反应放出CO2,共有______种(不考虑立体异构)。
K的一个同分异构体能发生银镜反应,也能使FeCl3溶液显紫色,苯环上有两个支链,苯环上的氢的核磁共振氢谱为二组峰,且峰面积比为1:1,写出K的这种同分异构体的结构简式。
A,B,C,D,E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57;B原子的L层P轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同,E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态。
(1)B,D可分别与A形成只含一个中心原子的共价化合物X和Y,其中X的电子式为;Y采取的杂化轨道类型为;C与A形成的常见化合物的分子构型为。
(2)B和D的最高价氧化物的晶体中熔点较高的是(填化学式),其原因。
(3)B与C比较电负性较大的是(填元素符号),E2+的核外电子排布式为。
(4)E2+与C的常见氢化物形成的配离子的离子反应方程式为。
(5)铝单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。若已知铝原子半径为d,NA表示阿伏加德罗常数,摩尔质量为M,则该原子的配位数,该晶体的密度可表示为______________,据下图计算,Al原子采取的面心立方堆积的空间利用率为 __________。
明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4、和H2SO4的工艺过程如下所示:
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O + 3S = 2K2SO4 + 2Al2O3 + 9SO2 + 48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是。
(2)从水浸后的滤液中得到K2SO4晶体的方法是。
(3)Al2O3在一定条件下可制得AlN,其晶体结构如图所示,该晶体中Al的配位数是。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时:
2SO2(g)+ O2(g) 2SO3(g)△H1 = -197 kJ /mol;
2SO3(g)△H1 = -197 kJ /mol;
H2O(g) H2O(l)△H2 = -44 kJ/mol;
H2O(l)△H2 = -44 kJ/mol;
2SO2(g)+ O2(g)+ 2H2O(g)=2H2SO4(aq) △H3 = -545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是。
焙烧948 t明矾(M =" 474" g/mol),若SO2的利用率为96%,可产生质量分数为98%的硫酸t。
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用两种方法制备甲醇:
反应Ⅰ:CO(g) + 2H2 (g)  CH3OH (g)DH1
CH3OH (g)DH1
反应Ⅱ:CO2(g)+ 3H2(g) CH3OH (g)+H2O(g)DH2
CH3OH (g)+H2O(g)DH2
① 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断DH1_______________0(填“<”、“=”或“>”)。
② 某温度下,将2molCO和6molH2充入2L密闭容器中充分反应,4分钟后反应达到平衡,测得CO的物质的量为0.4mol,则CO的反应速率为________________,此时的压强是反应前压强的___________倍。
(2)反应Ⅱ的平衡常数表达式为____________________,为了加快反应Ⅱ的反应速率,并且提高H2的转化率,采取的措施是_______________(填写正确选项的字母)。
a.增大CO2的浓度 b.增大H2的浓度
c.增大压强 d.加入催化剂
(3)工业上利用CO与水蒸气的反应,将有毒的CO转化为无毒的CO2,书写有关热化学反应方程式__________________________________。该反应在830K下进行时,初始浓度到达平衡的时间有如下的关系:
| CO的初始浓度(mol/L) |
2 |
4 |
1 |
3 |
| H2的初始浓度(mol/L) |
3 |
2 |
3 |
3 |
| 时间(min) |
8 |
6 |
12 |
n |
则n 为________min。
(4)近年来,科研人员新开发出一种甲醇和氧气以强碱溶液为电解质溶液的新型手机电池。该电池中甲醇发生反应的一极为______极、其电极反应式为_________________。
(5)用该电池作电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为L。