下列离子组一定能大量共存的是
| A.遇苯酚显紫色的溶液中:I-、AlO2-、SCN-、Mg2+ |
| B.使pH试纸变为蓝色的溶液中:Na+、C1-、S2-、ClO- |
| C.溶液中水电离产生的c(H+)、c(OH-)满足c(H+)·c(OH-)=10-24 :K+、NH4+、SO42-、NO3- |
| D.c(HCO3-)=0.1 mol/L的溶液中:NH4+、K+、SO32-、Br- |
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
| 选项 |
物质转化关系 |
甲 |
乙 |
丙 |
丁 |
|
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.CO和N2互为等电子体,22.4 L的CO气体与lmol N2所含的电子数相等 |
| B.0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1 NA |
| C.在铜与硫的反应中,1 mol铜参加反应失去的电子数目为NA |
| D.68 g的天然橡胶(聚异戊二烯)含有p键的数目为2 NA |
下列化学用语表示正确的是
A.HClO的电子式为 |
B.硝基苯的结构简式为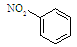 |
| C.饱和醇的通式CnH2n+2O |
D. 表示甲烷分子或四氯化碳分子的比例模型 表示甲烷分子或四氯化碳分子的比例模型 |
化学与生产、生活、社会密切相关,下列有关说法不正确的是:
| A.多用电子邮件、MSN、QQ等即时通讯工具,少用传真打印机属于“低碳生活”方式 |
| B.我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 |
| C.食品保鲜膜、一次性食品袋的主要成分是聚氯乙烯 |
| D.用红外光谱仪可以确定物质中是否存在某些有机原子团 |