配制100mL 1 mol·L-1的NaOH溶液,下列操作中错误的是
| A.在托盘天平上放两张大小相等的纸片,然后将NaOH固体放在纸片上进行称量 |
| B.把称得的NaOH放入适量蒸馏水的烧杯中,溶解、冷却,再把溶液移入容量瓶中 |
| C.用蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液也移入容量瓶中 |
| D.距刻度1—2cm时,用胶头滴管加入蒸馏水,直到液体凹面最低点恰好与刻度相切 |
把70%的HNO 溶液(密度为1.40 g·cm-3)加到等体积水中,稀释后HNO3溶液中溶质的质量分数是()
溶液(密度为1.40 g·cm-3)加到等体积水中,稀释后HNO3溶液中溶质的质量分数是()
| A.="0.35" | B.<0.35 |
| C.>0.35 | D.≤0.35 |
密度为ρ g·cm-3的溶液b mL,含有相对分子质量为Mr的溶质a g,其物质的量浓度为cb mol·L-1,质量分数为W。则下列关系式不正确的是( )
A.cB= mol·L-1 mol·L-1 |
B.a="ρ·b·w" g |
C.ρ=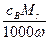 g·cm-3 g·cm-3 |
D.w=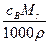 % % |
20 ℃时,饱和KCl溶液的密度为1.174 g·cm-3,物质的量浓度为4.0 mol·L-1,则下列说法中不正确的是()
| A.25 ℃时,饱和KCl溶液的浓度大于4.0 mol·L-1 |
B.此溶液中KCl的质量分数为 ×100% ×100% |
| C.20 ℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液 |
| D.将此溶液蒸发部分水,再恢复到20 ℃时,溶液密度一定大于1.174 g·cm-3 |
实验室常用98%(密度为1.84 g·mL-1)的浓硫酸配制1∶4的稀硫酸,此稀硫酸的密度为1.23 g·mL-1,则其物质的量浓度为( )
| A.4.6 mol·L-1 | B.5.7 mol·L-1 |
| C.3.88 mol·L-1 | D.18.4 mol·L-1 |
体积相同的某营养液两份,其配方如下:
| KCl |
K2SO4 |
ZnSO4 |
ZnCl2 |
|
| (1) |
0.3 mol |
0.2 mol |
0.1 mol |
— |
| (2) |
0.1 mol |
0.3 mol |
— |
0.1 mol |
两份营养液中各离子浓度()
| A.完全相同 | B.完全不同 |
| C.仅c(K+)相同 | D.仅c(Cl-)相同 |