(1)下列溶液中,c(H+)由小到大的排列顺序是
①0.1mol/L HCl溶液 ②0.1mol/L H2SO4溶液
③0.1mol/L NaOH溶液 ④0.1mol/L CH3COOH溶液
(2)25℃,柠檬水的pH是3,其中c(OH?)= 。
(3)25 ℃,有pH=12的氢氧化钠溶液100ml,要使它的pH降为11。应加蒸馏水的体积为 ml;若加pH=10的氢氧化钠溶液,应加 ml。
(4)25 ℃,pH=3盐酸和pH=11氨水等体积混合后溶液呈 性。(选填“酸”、“中”或“碱”)
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)海水中含有大量的氯化钠,氯化钠中的金属元素位于元素周期表第__________族。
(2)目前国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是____________(填物理变化或化学变化)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为食盐+H2O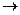 NaOH+H2+Cl2(未配平)。该反应中食盐的化学式是____________。利用电解所得气体制36.5%的浓盐酸1 000 t,最少需要消耗食盐____________t。
NaOH+H2+Cl2(未配平)。该反应中食盐的化学式是____________。利用电解所得气体制36.5%的浓盐酸1 000 t,最少需要消耗食盐____________t。
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下: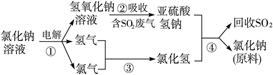
写出②④的化学反应方程式:____________________________________________。
上述亚硫酸氢钠与甲醛经过一定反应可以合成俗称“吊白块(雕白粉)”的物质。因吊白块对人体有害,不能用于食品漂白。其结构简式为HOCH2SO3Na,根据其结构特点,吊白块能发生的反应有____________。
| A.皂化反应 |
| B.聚合反应 |
| C.与金属钠反应 |
| D.氧化反应 |
某小城市近年来建成若干工厂,但不注意加强环境保护。造纸厂向城边河流中排放含Na2S的废水,热电厂排放热水,化工厂排放含Hg2+的废水,硫酸厂将尾气未经处理直接排放,炼钢厂排放大量棕色的烟气。虽然居民饮用从远郊水库引来的无毒水,但是不少居民渐感不适,河流中鱼儿也渐渐绝迹了,许多鲜花颜色失真。请回答:
(1)使居民中不少人身体不适的主要原因是________________________________________。
(2)分析河流中使鱼类绝迹的主要原因:_________________________________________。
(3)该城市中许多鲜花颜色失真的原因是__________________________________________。
(4)硫酸厂可采取措施消除污染,其措施是_______________________________________。
下面是甲、乙、丙、丁四个种群,在一个达到生态平衡的环境中所含有的总能量和残留农药DDT的平均浓度。
| 种群 |
甲 |
乙 |
丙 |
丁 |
| 能量(kJ) |
2.8×109 |
1.3×108 |
9.1×107 |
2.9×107 |
| DDT浓度(ppm) |
0.04 |
0.35 |
0.39 |
3.4 |
(1)这四个种群中属于生产者的是______________。
(2)写出四个种群的能量流动的渠道_______________________________。
(3)在能量流动的渠道中_____________越高,生物体内的DDT浓度也越高。
已知碳与氯气很难直接化合,请你推测CH4在Cl2中燃烧的方程式:__________________。
把下列14种能源按要求填入下表,并指出哪些是不可再生能源。
煤、石油、水力、汽油、铀、薪柴、酒精、天然气、液化气、热水、煤气、蒸汽、风力、电。
| 一次能源 |
二次能源 |
|
| 燃料能源 |
||
| 非燃料能源 |