(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式: 。
(2)已知反应N2(g)+3H2(g)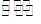 2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值: 。
2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值: 。
| 化学键 |
H—H |
N—H |
N=N |
| 键能(kJ/mol) |
436 |
391 |
945 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:
C(s,石墨)+O2(g) CO2(g) △H1=-393.5kJ?mol-1 ①
2H2(g)+O2(g) 2H2O(1) △H2=-571.6kJ?mol-1 ②
2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l) △H3 =-2599kJ?mol-1 ③
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变: 。
填空
(1)、甲溶液的pH是2,乙溶液的pH是4,求甲溶液和乙溶液的c(H+)之比为 。
(2)、电解饱和食盐水时,阴极析出气体是 (填化学式)。
(3)、现有学生做如下实验:将盛有滴加酚酞的0.1 mol/L NaHCO3溶液的试管微热时,观察到该溶液的浅红色加深;若冷却至室温时又变回原来的浅红色,发生该现象的主要原因是 。(结合离子反应方程式说明)
(4)、已知25℃时,醋酸和亚硫酸的电离平衡常数:醋酸K=1.75×10-5 ,亚硫酸K1=1.54×10-2、
K2=1.02×10-7。则25℃时,相同浓度醋酸和亚硫酸溶液的酸性强弱:CH3COOH H2SO3(填>、<或=)。
(5)、向明矾溶液中逐滴加入Ba(OH)2溶液,若加至铝离子刚好完全沉淀,请写出反应的离子反应方程式: 。
(6)、炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请写出铁锅腐蚀正极的电极反应式: 。
某河道两旁有甲乙两厂,它们排放的工业废水中含有K+、Ag+、Fe3+、Cl—、OH—、NO3—六种杂质离子,甲厂的废水是无色透明的,乙厂的废水有明显的颜色。
(1)甲厂的废水中所含的三种离子是 。
(2)乙厂的废水有明显的 色
(3)将甲厂和乙厂的废水按适当的比例混合,可使废水中的 (填离子符号) 化为沉淀,过滤所得的废水中主要含 ,可用来浇灌农田。
按要求用化学用语回答下列问题:
(1)除去混入Fe2O3粉末中少量Al2O3杂质的试剂是 ,
离子方程式为 。
(2)在呼吸面具中,Na2O2 起反应的化学方程式为 。
(3)镁带着火时,不能用液态CO2灭火剂来灭火的原因是___ _。(用化学方程式表示).
(4)氯气用于漂白、消毒时,能起漂白、消毒作用的物质是_____ ____(写化学式).
某研究性学习小组对漂白液进行了如下实验探究:取漂白液少量,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,可以证明漂白液具有的性质有__________。
有下列物品或设备:
①陶瓷餐具 ②砖瓦
③水泥路桥 ④门窗玻璃
⑤水晶镜片 ⑥石英钟表
⑦玛瑙手镯 ⑧硅太阳能电池
⑨光导纤维 ⑩计算机芯片
(1)用到硅单质的是______ _______。
(2)所用材料为SiO2或要用到SiO2的是_____ _______。
(3)所用材料为硅酸盐的是_____ _______。
原电池和电解池都能实现能量的置换。回答下列问题:
(1)可将化学能转化为电能是_________池;
(2)下列反应能设计成原电池的是:
① 2FeCl3+Fe=3FeCl2
② AlCl3+3NH3·H2O= Al(OH)3↓+3NH4Cl
③ NaOH+HC1=NaC1+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为: 。
(4)右图装置当闭合电键时,电表显示有电流通过。则Pt极的电极反应式: ; 当甲中产生0.1 mol气体时,乙中析出铜的质量应为________g。