生态农业涉及农家肥料的综合利用。某种肥料经发酵得到一种含有甲烷(CH4) 、二氧化碳、氮气的混合气体8.96L(标准状况)。该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:
CH4+CuO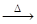 CO2↑+H2O↑+Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入足量的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。
CO2↑+H2O↑+Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入足量的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。
(1) 用单线桥法标明CH4+CuO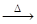 CO2↑+H2O↑+Cu电子转移的方向和数目
CO2↑+H2O↑+Cu电子转移的方向和数目
(2) 原混合气体的物质的量是____________;(3)求原混合气体中甲烷及氮气体积。
在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
| 锌的质量/g |
锌的形状 |
温度/℃ |
溶解于酸所花的时间/s |
|
| A |
2 |
薄片 |
5 |
400 |
| B |
2 |
薄片 |
15 |
200 |
| C |
2 |
薄片 |
25 |
100 |
| D |
2 |
薄片 |
35 |
50 |
| E |
2 |
薄片 |
45 |
25 |
| F |
2 |
粉末 |
15 |
5 |
试求:
(1)画一幅以时间对温度的曲线图(纵轴表示时间,横轴表示温度).
(2)利用所画的曲线图,关于温度影响反应速率你能得出什么结论?
(3)20℃时,2g锌箔溶解于酸中需花多少时间?
(4)对比结果B与F,解释F为什么那么快?
下图为将Zn投入一定浓度体积的H2SO4中,解释图像的成因(纵坐标为H2的生成速率)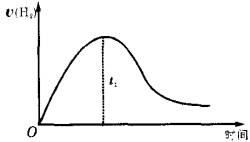
试将外界条件对化学反应速率的影响结果填入下表中。
KClO3与NaHSO3间的氧化还原反应生成Cl-和 的速率与时间关系如下图,已知反应速率随c(H+)的增加而加快,试说明
的速率与时间关系如下图,已知反应速率随c(H+)的增加而加快,试说明
(1)为什么反应开始时,反应速率增大?
(2)反应后期,反应速率逐渐降低的主要原因是___________。
合成氨反应,在其他条件不变,增大体系压强10倍,化学反应速率可增大___________倍。