(14分)工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
| A.连接全部仪器,使其成为如图装置,并检查装置的气密性。 |
| B.称取研细的辉铜矿样品1.000g。 |
| C.将称量好的样品小心地放入硬质玻璃管中。 |
| D.以每分钟1L的速率鼓入空气。 |
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2 +2Cu。
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是_________。
| 滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
25.00 |
1.04 |
21.03 |
| 2 |
25.00 |
1.98 |
21.99 |
| 3 |
25.00 |
3.20 |
21.24 |
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是 (写一种即可)。
(5)已知在常温下FeS 的 Ksp= 6.25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系: c2 (H+) ·c(S2-) = 1.0×10-22。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为 lmol/L,应调节溶液的c(H十)为__________________。
(6)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式______.
在一定条件下可实现下图所示物质之间的变化,请填写以下空白:
已知:①孔雀石的主要成分是碱式碳酸铜 Cu2(OH)2CO3
② NaAlO2在酸性条件下可转化为 Al(OH)3
⑴明矾的化学式是。G的化学式是
⑵上图中物质F的电子式为。B电解的化学方程式
⑶沉淀H加热分解的化学方程式
明矾溶液与过量NaOH溶液反应的离子方程式为 。
⑷图中所得G和D都为固体,混合后在高温下可发生反应,该反应化学方程式为:
__________________________________________________________。
⑴棉花纤维的化学成分是。大豆油的主要成分是 。蚕丝和羊毛的化学成分是。如何区分棉纤维和羊毛?
⑵一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
1) 在人体中进行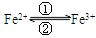 的转化时,①中的Fe2+作剂;②中的Fe3+作剂
的转化时,①中的Fe2+作剂;②中的Fe3+作剂
2) “服用维生素C,可使食物中的Fe3+ 还原成Fe2+”这句话指出,维生素C在这一反应中作剂,具有性;
3) 市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐。此反应的离子方程式为。
⑶汽车已经成为重要的交通工具,但其排放的尾气是空气的主要污染物之一。已知汽车尾气中的主要污染物有:CmHn(烃)、SO2、NOX、CO和C等,请回答下列有关问题。
1)若用CmHn表示汽油的主要组成,CmHn在空气中完全燃烧的化学方程式为,汽油燃烧产生能量为汽车提供了动力,这一过程中能量的转化是由能转化为热能,最终转化为机械能;
2)通过车用燃油的精炼加工处理,可减少汽车尾气中的(填化学式,多填本空不得分)排放;
3)目前汽车尾气多采用催化转化的方法加以治理,写出在催化剂作用下NOX与CO反应的化学方程式。
(15分,每空3分)有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
 实验步骤 实验步骤 |
解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为:。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
(2)A的分子式为:。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团:。 |
(4)A的核磁共振氢谱如下图: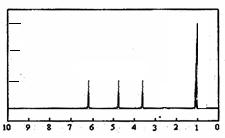 |
(4)A中含有种氢原子。 |
| (5)综上所述,A的结构简式。 |
(6分,每空2分)在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热量。已知0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量。
(1)写出肼和双氧水反应的热化学方程式________________________。
(2)已知H2O(l)==H2O(g);△H=+44KJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是_____________。
(3)已知N2(g) + 2O2(g) ="=" 2NO2(g);△H=+67.7KJ/mol,
N2H4(g) + O2(g) ="=" N2(g)+2H2O(g);△H= —534KJ/mol,
则肼与NO2完全反应的热化学方程式为__________________________。
(12分,每空2分)在体积一定的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)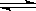 CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应正向为ΔH0;若某一温度压强下,熵变ΔS<0,则该正向反应能否自发进行(选填“能”或“不能”)
(2)能判断该反应达到化学平衡状态的依据是。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v正(H2)=v逆(H2O) (d)c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式: 0.9·c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃
其它条件不变,升高温度,容器内混合气体的密度(填“增大”、“减小”或“不变”)。
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡。若反应开始时CO与H2O的浓度分别为0.200 mol·L–1和0.100 mol·L–1,平衡时CO的转化率。