下列离子方程式书写正确的是
| A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O |
| B.氢氧化钡溶液与盐酸反应:OH-+H+ = H2O |
| C.硫酸铜溶液与氢氧化钡溶液混合:Cu2+ + 2 OH-= Cu(OH)2↓ |
| D.钠投入水中:Na +H2O = Na+ + OH- + H2↑ |
在反应3Cl2+6KOH 5KCl+KClO3+3H2O中,得电子的原子和失电子的原子个数比是( )
5KCl+KClO3+3H2O中,得电子的原子和失电子的原子个数比是( )
| A.5∶1 | B.1∶5 | C.1∶1 | D.3∶1 |
已知反应:①Cu+2H2SO4(浓) SO2↑+2H2O+CuSO4;②Cu+4HNO3(浓)====Cu(NO3)2+
SO2↑+2H2O+CuSO4;②Cu+4HNO3(浓)====Cu(NO3)2+
2NO2↑+2H2O(剧烈);③3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O(较慢),由此可知下列四种物质的氧化性由强到弱的顺序为__________。(填字母)
| A.浓H2SO4 | B.稀H2SO4 | C.浓HNO3 | D.稀HNO3 |
KMnO4是常用的氧化剂,酸化的KMnO4溶液可将Na2SO3氧化成Na2SO4。该反应中氧化剂和还原剂的个数比为2∶5,则在生成物中Mn的化合价是( )
| A.+6 | B.+4 | C.+2 | D.0 |
现有Fe、Cu、Ag三种金属,欲证明三者的活动性顺序,需用的一组试剂是( )
| A.盐酸与稀硫酸 | B.AgNO3与CuSO4 |
| C.FeSO4与CuSO4 | D.AgNO3与Hg(NO3)2 |
在一定条件下PbO2与Cr3+反应,产物是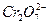 和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为()
和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为()
| A.3.0 mol | B.1.5 mol | C.1.0 mol | D.0.75 mol |