在化学反应中,反应前与反应后相比较,肯定不变的是( )
①元素的种类 ②原子的种类
③分子的数目 ④原子的数目
⑤反应前物质的总质量和反应后物质的总质量
⑥如果水溶液中反应,则反应前与反应后阳离子所带的正电荷总数
⑦反应前反应物的总能量与反应后生成物的总能量
| A.①②③④⑦ | B.①②⑤⑥⑦ |
| C.①②④⑤ | D.②③⑤⑥⑦ |
现有两种只含C、H两种元素的有机物混合气体0.1mol,完全燃烧生0.12molCO2和0.2molH2O,则该混合气体中()
A.一定含有甲烷 B.一定含有乙烯 C.可能含有甲烷 D.不能确定
菲的结构简式可表示为右图,若菲分子中有1个H原子被Cl原子取代,则所得一氯取代产物有()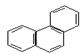
| A.4种 | B.5种 | C.10种 | D.14种 |
已知A物质的分子结构简式如下: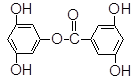 , lmol A与足量的NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为()
, lmol A与足量的NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为()
| A.5mol | B.6mol | C.7mo1 | D.8mo1 |
A、B两种烃,它们含碳质量分数相同,下列关于A和B的叙述正确的是()
A.A和B一定是同分异构体 B.A和B不可能是同系物
C.A和B最简式一定相同 D.A和B的化学性质相似
某烃结构如下: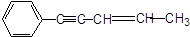 ,有关其结构说法正确的是()
,有关其结构说法正确的是()
| A.所有原子可能在同一平面上 | B.所有原子可能在同一条直线上 |
| C.所有碳原子可能在同一平面上 | D.所有氢原子可能在同一平面上 |