菲的结构简式可表示为右图,若菲分子中有1个H原子被Cl原子取代,则所得一氯取代产物有( ) 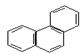
| A.4种 | B.5种 | C.10种 | D.14种 |
某溶液中仅含Na+、H+、OH-、CH3COO-四种离子,下列说法错误的是
| A.溶液中四种粒子之间不可能满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B.若溶液中部分粒子间满足:c(CH3COO-)=c(Na+)则该溶液一定呈中性 |
| C.若溶液中溶质仅为CH3COONa,则粒子间一定满足: C(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.若溶液中的溶质为CH3COONa和CH3COOH,则溶液中粒子间一定满足: |
C(CH3COO-)>c(Na+)>c(H+)>c(OH-)
在密闭容器中,一定量混合气体发生下列反应: aM(g)+ bN(g) cW(g),达一平衡后,测得M气体的浓度为0.5mol/L。当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是
cW(g),达一平衡后,测得M气体的浓度为0.5mol/L。当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是
| A.反应速率增大 | B.平衡向右移动 |
| C.N的转化率提高 | D.W的体积分数降低 |
T℃时在1L密闭容器中A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图1所示;若保持 其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图2所示。则下列结论正确的是 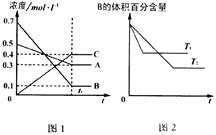
A.在达平衡后,保持其他条件不变,增大压强,平衡向正反应方向移动
B.保持其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
C.在达平衡后,保持压强不变,通入稀有气体,平衡向正反应方向移动
D. T℃时,若由0.3mol·L –1A、0.1mol·L –1B、0.4mol·L –1C反应,达到平衡后,C的浓度为0.4mol·L –1
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
| A.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e一=4OH- |
| B.用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液的离子方程式为: 2C1-+2H2O  H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
| C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+ |
| D.钢铁发生电化学腐蚀的负极反应式:Fe一2e—=Fe2+ |
单斜硫和正交硫转化为二氧化硫的能量变化图如右,下列说法正确的是 
| A.S(s,单斜) = S(s,正交)△H = +0.33kJ·mol -1 |
| B.正交硫比单斜硫稳定 |
| C.相同物质的量的正交硫比单斜硫所含有的能量高 |
| D.①式表示断裂lmol O2中的共价键所吸收的能量比形成1mol SO2中的共价键所放出的能量少297.16kJ |