100ml 浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气总量,可采用的方法是
| A.加入少量浓盐酸 | B.加入几滴氯化铜溶液 |
| C.加入适量蒸馏水 | D.加入适量的氯化钠溶液 |
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g) + 2B(g) xC(g)ΔH=-192kJ·mol-1。向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是
xC(g)ΔH=-192kJ·mol-1。向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是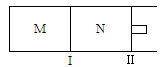
| A.若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N) |
| B.若x>3,达到平衡后B的转化率关系为:α(M)>α(N) |
| C.若x<3,C的平衡浓度关系为:c(M)>c(N) |
| D.x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等 |
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)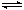 CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是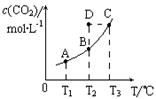
A.反应CO(g)+H2O(g)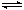 CO2(g)+H2(g)的△H >0 CO2(g)+H2(g)的△H >0 |
| B.在T2时,若反应进行到状态D,则一定有v(正)<v(逆) |
| C.欲使D状态变为C状态,可以采取快速升温至T3的方式 |
| D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
反应:①PCl5(g) PCl3(g)+Cl2(g)②2HI(g)
PCl3(g)+Cl2(g)②2HI(g) H2(g)+I2(g) ③2NO2(g)
H2(g)+I2(g) ③2NO2(g) N2O4(g)在一定条件下,达到化学平衡时,反应物的转化率均是 a%,若保持各反应的温度和容器的体积都不改变,分别再加入一定量的各自的反应物,则转化率
N2O4(g)在一定条件下,达到化学平衡时,反应物的转化率均是 a%,若保持各反应的温度和容器的体积都不改变,分别再加入一定量的各自的反应物,则转化率
| A.均不变 | B.①增大,②不变,③减少 |
| C.均增大 | D.①减少,②不变,③增大 |
1 L某溶液中含有的离子如下表:
| 离子 |
Cu2+ |
Al3+ |
NO |
Cl- |
| 物质的量浓度(mol/L) |
1 |
1 |
a |
1 |
用惰性电极电解该溶液,当电路中有3 mol e-通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是
A.a=3B.电解后溶液的c(H+)=1mol·L-1
C.电解该溶液相当于只电解CuCl2溶液D.阴极析出的金属是铜与铝
T℃时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是
A.T℃时,该反应的化学方程式为:X(g)+Y(g) 2Z(g),平衡常数K=4 2Z(g),平衡常数K=4 |
| B.平衡时X、Y的转化率相同 |
| C.达到平衡后,恒温将容器体积扩大为3 L,平衡向逆反应方向移动 |
| D.T ℃时,若起始时X为0.60mol,Y为1.00 mol,则平衡时Y的 |
转化率小于80%