印刷铜制电路板的“腐蚀液”为FeCl3溶液。已知铜、铁均能与FeCl3溶液反应,反应的化学方程式分别为①Cu+2FeCl3=2FeCl2+CuCl2 ②Fe+2FeCl3=3X。
(1)写出化学方程式 ②中X的化学式 ;
(2)现将一包铜、铁的混合粉末加入盛有一定量FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体剩余,那么烧杯内的固体中一定含有的物质是 。
【2015年辽宁省丹东市】请回答下列化学与人类生活相关的问题:
(1)人们的生活离不开金属,若铁制品已锈蚀,应及时除去,请写出用稀盐酸除去铁锈的化学方程式: ;
(2)人们的生活离不开燃烧,可燃物燃烧除需要氧气外,还需要满足的条件是 ;煤块粉碎后,在空气中燃烧得更快、更充分,这是因为 。
【2015年北京市】依据下图进行实验(夹持仪器略去)。实验过程:①通入 ,点燃酒精灯,一段时间后,a、b中均无明显现象;②熄灭酒精灯,立即改通
,点燃酒精灯,一段时间后,a、b中均无明显现象;②熄灭酒精灯,立即改通 ,a中无明显现象,b中红磷燃烧。
,a中无明显现象,b中红磷燃烧。
(1)实验过程②中,红磷燃烧的化学方程式为 。
(2)实验过程②中,对比a、b中的实验现象,可知可燃物燃烧的条件之一是 。
(3)实验过程中,能说明可燃物燃烧需要氧气的实验是 。
【2015年福建省泉州市】在实验室里,小明与同学欲用下图所示装置(气密性良好)和药品制取初中化学常见气体并验证其有关性质。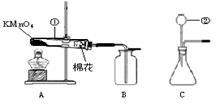
(1)写出图中标有序号的仪器名称:① ,② 。
(2)点燃A中的酒精灯制取并收集氧气,反应的化学方程式为 。待检验到B中氧气已收集满,接下来的操作是 ,把集气瓶盖好玻璃片后,正放在桌面上。
(3)将点燃的蜡烛放入集满氧气的集气瓶中,可观察到 且瓶壁上有水雾出现,证明蜡烛燃烧有水生成。接着,将蜡烛从集气瓶中取出, (填实验步骤和现象),证明蜡烛燃烧还生成了二氧化碳。
(4)小明同学发现装置C有一处明显错误: ,将装置C改正后放入适量的药品:
和 ,即开始制取 气体(写一种)。
【2015年甘肃省兰州市】根据下列装置,结合所学化学知识回答下列问题。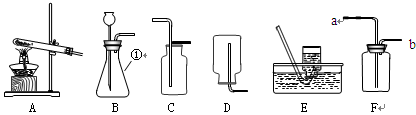
(1)写出标号仪器①的名称: ;
(2)实验室选择装置A用高锰酸钾制取氧气时,你认为A装置存在的问题是 ,选择收集装置应依据氧气 的性质,该反应的化学方程式是 ;
(3)实验室可以选择装置 (填字母)制取并收集CO2气体,该反应的化学方程式是 ,验满的方法是 ;
(4)通常情况下,SO2是一种无色、有刺激性气味的气体,密度比空气大,易溶于水且水溶液显酸性。实验室里,用亚硫酸钠固体和浓硫酸反应制取SO2。实验室制取SO2选择的发生装置是 (填字母),若选择F装置收集SO2,气体应该从 口(填“a”或“b”)进入,实验结束后剩余的SO2气体用氢氧化钠溶液吸收,吸收的目的是 。
【2015年广东省揭阳市】根据下列A-D的四个实验,请按要求填空: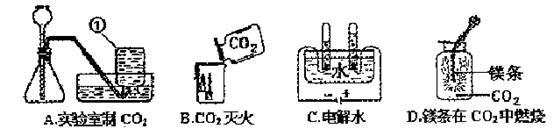
(1)A实验中,请写出标号为①的仪器名称 ,实验室制取二氧化碳所用药品为 ,指出用该装置来制取二氧化碳气的一个明显错误的地方是 ,是否可以用该装置来制取氧气呢? (填“是”或“否”)
(2)B实验中观察到的现象是 。
(3)C实验中正极产生的气体是 (写化学式),由此实验得出水是由 组成的。
(4)D实验中将镁条在空气中点燃后再放入充满CO2的集气瓶中,发现镁条继续剧烈燃烧,发出白光,放热,产生一种白色固体和一种黑色固体,已知该反应为置换反应,则反应的化学方程式为 。