25 ℃时,水的电离达到平衡:H2O 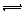 H++OH-;△H>0,下列叙述正确的是 ( )
H++OH-;△H>0,下列叙述正确的是 ( )
A 向水中加入氨水,平衡逆向移动,c(OH-)降低
B 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D 将水加热,KW增大,pH不变
下列溶液一定呈中性的是()
| A.pH=7的溶液 | B.c(H+)=c(OH-)=10-6mol/L溶液 |
| C.使石蕊试液呈紫色的溶液 | D.酸与碱恰好完全反应生成的正盐溶液 |
在下列叙述中,不能说明醋酸是弱电解质的是( )
| A.室温下,0.1mol·L-1的CH3COONa溶液的pH=8 |
| B.室温下,0.1mol·L-1的CH3COOH溶液的pH="3" |
| C.醋酸中加水后,溶液的pH升高 |
| D.0.1mol·L-1的CH3COOH导电能力不如0.1mol·L-1的盐酸强 |
某溶液中由水电离出来的C(OH—)=10-12mol/L,则该溶液中的溶质不可能是( )
| A.HCl | B.NaOH | C.NH4Cl | D.H2SO4 |
原电池的正极和电解池的阴极所发生的反应分别是:()
| A.氧化、还原 | B.还原、氧化 |
| C.氧化、氧化 | D.还原、还原 |
某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为()
| A.铝 | B.铜 | C.锡 | D.硅 |