有a、b、c、d 4 种金属,将a与b用导线连接起来,浸入电解质溶液中,b不易腐蚀。将a、d分别投入等浓度盐酸中,d比a反应剧烈。将铜浸入b的盐溶液里无明显变化。如果把铜浸入c的盐溶液里,有金属c析出。据此判断它们的活动性由强到弱的顺序是( )
| A.d>c>a>b | B.d>a>b>c | C.d>b>a>c | D.b>a>d>c |
在0.1 mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH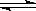 CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
在一定温度下的密闭容器中,当下列物理量不再变化时,表明A(s) +2B(g)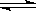 C(g)+ D(g)已达到平衡的是
C(g)+ D(g)已达到平衡的是
| A.混合气体的压强 | B.混合气体的分子数目 |
| C.混合气体的密度 | D.混合气体的总物质的量 |
微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-===ZnO+H2O;Ag2O+H2O+2e-===2Ag+2OH-根据上述反应式,判断下列叙述中正确的是
| A.在使用过程中,电池负极区溶液的pH减小 |
| B.使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C.Ag2O是负极,Zn是正极 |
| D.Zn电极发生还原反应,Ag2O电极发生氧化反应 |
在平衡体系Ca(OH)2(s)  Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
| A.加入少量MgCl2固体 | B.加入少量Na2CO3固体 |
| C.加入少量KCl固体 | D.加入少量Ba(OH)2固体 |
60mL 0.5 mol·L-1氢氧化钠溶液和40mL 0.4 mol·L-1硫酸相混合后,溶液的pH约为
| A.0.5 | B.1.7 | C.10.9 | D.13.2 |